
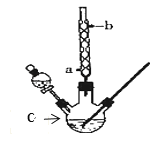
����Ŀ��ij��ѧ����С���������ͼ��ʾ��װ����ȡ����������ͼ�мг������ͼ���װ������ȥ������֪�������ݣ�
�Ҵ� | ���� | �������� | 98%Ũ���� | |
�۵�/�� | ��117.3 | 16.6 | ��83.6 | |
�е�/�� | 78.5 | 117.9 | 77.5 | 338.0 |
��ش��������⣺
(1)����C������Ϊ______�����������ܵ�������_____��
(2)��C�м��뷴Ӧ�����ַ�Ӧ��C�еĻ���ﵹ��װ�б���̼������Һ���ձ��г����ϴ�ӡ�����̼������Һ�����ǣ�����ĸ����_____
A.�к����Ტ�ܽ��Ҵ�
B.̼������Һ�ʼ��ԣ�����������������ˮ��
C.�����������������ɣ���������
D.���������ڱ���̼������Һ�е��ܽ�ȱ���ˮ�и�С�������ڷֲ�����
(3)�������ϴ�ӡ����÷�Һ��Ϊ�˽�һ���ᴿ�����������ɲ�������ķ���������ʱ�����¶���__���ң��¶ȼƵ�ˮ����Ӧλ��____��
(4)��ʵ��������������Ϊ2.4g���Ҵ�����Ϊ2.1g���õ������IJ�Ʒ����Ϊ2.64g�������������IJ�����______��
(5)��������������������Һ������Ӧ�Ļ�ѧ����ʽΪ____________��
���𰸡�������ƿ �������� AD 77.5�� ��֧�ܿ�ƽ�� 75% CH3COOC2H5+NaOH![]() CH3COONa+CH3CH2OH
CH3COONa+CH3CH2OH
��������
(1)����C������Ϊ������ƿ�����������ܵ��������������������ԭ�������ʣ�
(2)����������ԣ��ܺͱ���̼������Һ��Ӧ���ѱ����գ����������ڱ���̼������Һ�е��ܽ�Ƚ�С��
(3)���ݱ������ݿ�֪��������������ķе�Ϊ77.5�棬�¶ȼƵ�ˮ����Ӧλ��֧�ܿ���ƽλ�ã���ʱ������¶�Ϊ����¶ȣ�
(4)������Ҵ��ķ�ӦΪCH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O��2.4g�����2.1g�Ҵ����ʱ��֪�Ҵ�����������2.4g��������������������۲��������ò���=
CH3COOCH2CH3+H2O��2.4g�����2.1g�Ҵ����ʱ��֪�Ҵ�����������2.4g��������������������۲��������ò���=![]() ��100%���㣻
��100%���㣻
(5)��������������������Һ������ȫˮ�ⷴӦ�����ɴ����ƺ��Ҵ����ݴ�д����ѧ����ʽ��
(1)����C������Ϊ������ƿ�����������ܵ��������������������ԭ�������ʣ�
(2)����������ԣ��ܺͱ���̼������Һ��Ӧ���ѱ����գ����������ڱ���̼������Һ�е��ܽ�Ƚ�С�����ڷ��룬�ʺ���ѡ����AD��
(3)���ݱ������ݿ�֪��������������ķе�Ϊ77.5�棬�����ռ���ƷӦ�����¶���77.5�����ң������¶ȼƵ�ˮ����Ӧλ��֧�ܿ���ƽλ�ã�������¶Ȳ�������¶ȣ�
(4)������Ҵ��ķ�ӦΪCH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O����Ϊ60��46��2.4��2.1������2.4g�����2.1g�Ҵ����ʱ���Ҵ�������2.4g���������������������۲���=
CH3COOCH2CH3+H2O����Ϊ60��46��2.4��2.1������2.4g�����2.1g�Ҵ����ʱ���Ҵ�������2.4g���������������������۲���=![]() ��88g=3.52g�����������IJ���=
��88g=3.52g�����������IJ���=![]() ��100%=75%��
��100%=75%��
(5)��������������������Һ������ȫˮ�ⷴӦ�����ɴ����ƺ��Ҵ�����ѧ����ʽΪCH3COOC2H5+NaOH=CH3COONa+CH3CH2OH��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ը�����������Ҫ�ɷ�ΪAl2O3��Fe2O3������������FeS2��Ϊԭ�ϣ����������������Fe3O4�IJ��ֹ���������ͼ����������������ǣ� ��
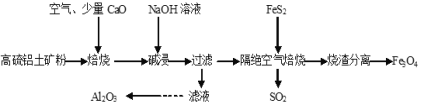
A.�����������ѡ���ô����������е�Fe3O4�������
B.������������ʱ�����Ϸ�Ӧ���ĵ�n(FeS2)��n(Fe2O3)=1��5
C.����Һ��ͨ�����CO2�����ˡ�ϴ�ӡ����ճ������Ƶ�Al2O3
D.����CaO���Լ���SO2���ŷ�ͬʱ���ɽ�������CaSO4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��O2������Al��CO2��ع���ԭ����ͼ��ʾ���õ�ص�����������Ч����CO2����ط�Ӧ����Al2(C2O4)3����Ҫ�Ļ���ԭ�ϡ��õ�ض��̼�缫�ķ�ӦʽΪ�� 6O2 + 6e = 6O2 6CO2+6O2 = 3C2O42+6O2����װ�ù���ʱ����˵������ȷ����
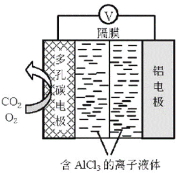
A.���̼�缫������������ɢ���缫����
B.���缫Ϊ�ϵĵ��Ʊȶ��̼�缫�ϵĸ�
C.��Ӧ������O2�������Ǵ���
D.�õ�ص��ܷ�ӦʽΪ��2Al+6CO2=Al(C2O4)3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�Ͼ�﮵�ز��Ϻ��������(LiCoO2)�������ʯī�����۵ȡ����շϾ�﮵�����ܵĹ����������£�
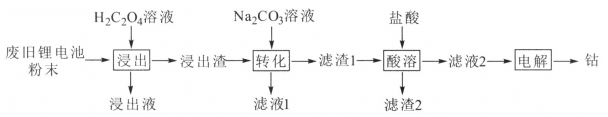
��֪��Ksp(CoC2O4)=6.0��10-8��Ksp(CoCO3)=1.5��10-13��
�ش��������⣺
(1) LiCoO2�У�CoԪ�صĻ��ϼ�Ϊ______________��
(2)������Һ������Ҫ�ɷ���LiHC2O4��Al(HC2O4)3����������������Ҫ�ɷ���CoC2O4����������������CoC2O4�Ļ�ѧ����ʽΪ__________����H2C2O4��������CoC2O4�IJ��ʷ����ή�ͣ�ԭ����____��
(3)��ת�����м���Na2CO3��Һ������Ӧ�����ӷ���ʽΪ______________���÷�Ӧ���еij̶Ƚϴ���ͨ��������ƽ�ⳣ��K������ԭ��______________��
(4)�������ʱװ����ͼ��ʾ�������ĵ缫��ӦʽΪ_______������a���еĵ��Һ�ɷ��ع������ʹ�á�
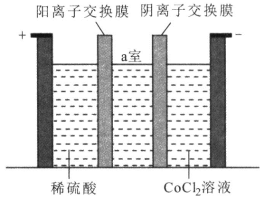
(5)ij�Ͼ�﮵�ط�ĩ��LiCoO2����������Ϊ49%����50�ָ÷��Ͻ��л������ã����õ���5.9�֣����ܵĻ�����Ϊ_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A.��ӦC(s)��H2O(g)![]() CO(g)��H2(g)��ƽ����뵥��̼ƽ��ض�������Ӧ�����ƶ�
CO(g)��H2(g)��ƽ����뵥��̼ƽ��ض�������Ӧ�����ƶ�
B.A2(g)��3B2(g)![]() 2AB3(g)��ƽ�������������ѹǿ���䣬����ͨ��0.2mol A2��0.6mol B2��ƽ��������Ӧ�����ƶ�����A2��ת����һ�����
2AB3(g)��ƽ�������������ѹǿ���䣬����ͨ��0.2mol A2��0.6mol B2��ƽ��������Ӧ�����ƶ�����A2��ת����һ�����
C.2RO2(g)��O2(g)![]() 2RO3(g) ��H����197kJ��mol��1�������¶ȣ�����Ӧ���ʼ�С
2RO3(g) ��H����197kJ��mol��1�������¶ȣ�����Ӧ���ʼ�С
D.��һ���¶��£�һ���ݻ����ܱ������з�����Ӧ��C(s)��H2O(g)![]() H2(g)��CO(g)���������������ƽ�������������ٷ����仯ʱ����Ӧ�ﵽƽ��
H2(g)��CO(g)���������������ƽ�������������ٷ����仯ʱ����Ӧ�ﵽƽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���뵼���е��ʡ���Ԫ�������Ԫ�������֮�֣�������Ԫ�뵼��CuAlO2(��Cu2Al2O4)����ȡ��������CuO��Al2O3��Al(OH)3���ȵķ������Է������ش�
(l)��������»�ѧ����ʽ��
_______CuO��_______ Al2O3![]() _______Cu2Al2O4��_______ ��
_______Cu2Al2O4��_______ ��
(2)������Ӧ�ܷ�����������Ҫ��_____________��
(3)Al(OH)3�м�ʽ����ʽ���ֵ��뷽ʽ����25��ʱ������ʽ����ΪAl(OH)3![]() AlO2����H����H2O K��2.0��10��13������Al(OH)3��OH��
AlO2����H����H2O K��2.0��10��13������Al(OH)3��OH��![]() AlO2����2H2O��ƽ�ⳣ��K����_______(��ʽ������)���÷�Ӧ����H_______(����<����>����������)0��
AlO2����2H2O��ƽ�ⳣ��K����_______(��ʽ������)���÷�Ӧ����H_______(����<����>����������)0��
(4)��ʵ��ⶨ����AlO2���� ����ʽӦ����[Al(OH)4]������AlCl3��Һ��Na[Al(OH)4]��Һ���õ����ӷ���ʽ��_________________��
(5)��ʯī�缫���Na[Al(OH)4] ��Һ����ȡ��Ʒ����Al(OH)3�ķ���֮һ���õ�ⷴӦ�����ӷ���ʽ��_________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ԭ���ڻ�ѧ��ҵ���й㷺Ӧ�á���ͼ��ʾһ�����أ�װ�е��Һa��X��Y������缫�壬ͨ��������ֱ����Դ��������ش��������⣺
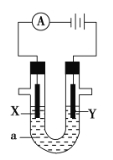
��1����X��Y���Ƕ��Ե缫��a��AgNO3��Һ��ʵ�鿪ʼʱ��ͬʱ�����߸����뼸��ʯ����Һ����
��������Y�缫�ϵĵ缫��ӦʽΪ ����Y�缫�����۲쵽��ʵ�������� ������õ缫��Ӧ����ķ����� ��
��X�缫�ϵĵ缫��ӦʽΪ ��
��2����Ҫ�õ�ⷽ���������������Һaѡ��Ni(NO3)2��Һ����
��X�缫�IJ����� ���缫��ӦʽΪ ��
��Y���IJ����� ���缫��ӦʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����(Se)������������Ԫ�أ���Ԫ�����ڱ��е�λ����ͼ��ʾ�����й�����Ԫ�ص�������ȷ����

A.��Ԫ��λ��Ԫ�����ڱ��������ڵ�IVA��
B.H2Se��HBr�ȶ�
C.���ķǽ����Ա�S��
D.������������Ӧˮ����Ļ�ѧʽΪH2SeO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ں��ݾ��ȵ������н��з�Ӧ��2A(g)+B(g)![]() 3C(g)+D(s)��H=-akJ��mol-1(a>0)������˵������ȷ����
3C(g)+D(s)��H=-akJ��mol-1(a>0)������˵������ȷ����
A.������ѹǿ���䣬������Ӧ�ﵽƽ��״̬
B.��Ӧ������A��B��ת����ʼ����ͬ
C.����A��Ũ�ȣ�ƽ��ʱB�������������
D.������������ܶȲ��䣬������Ӧ�ﵽƽ��״̬
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com