
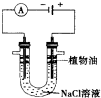
 ����һ�ֹ���Ԫ�أ�����������õĽ�������ش����и��⣺
����һ�ֹ���Ԫ�أ�����������õĽ�������ش����и��⣺
| ||
| ||
| ||
| 11.2g |
| 56g/mol |
0.2mol��
| ||||
| 2��(2-0) |
| ||


 �ƸԺ���ȫ�����Ų��Ծ�ϵ�д�
�ƸԺ���ȫ�����Ų��Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��HCN������ˮ |
| B��HCN��Һ�ܵ��� |
| C��1mol/L��������Һ��pHԼΪ3 |
| D��10 mL1 mol?L-1HCNǡ����10 mL 1 mol?L-1 NaOH��Һ��ȫ��Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
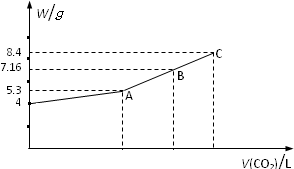 ��NaOH��Һ��ͨ��CO2�����ַ�Ӧ���ڵ�ѹ�͵����£�С�ĵؽ���Һ���ɣ��õ���ɫ�Ĺ���M��ͨ��CO2�����V��CO2������״������M������W�Ĺ�ϵ����ͼ��
��NaOH��Һ��ͨ��CO2�����ַ�Ӧ���ڵ�ѹ�͵����£�С�ĵؽ���Һ���ɣ��õ���ɫ�Ĺ���M��ͨ��CO2�����V��CO2������״������M������W�Ĺ�ϵ����ͼ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ����ͨ�����ò�ͬ��ѧ��Ӧ�ֱ��Ƶ�B��C��D �������ʣ�
����ͨ�����ò�ͬ��ѧ��Ӧ�ֱ��Ƶ�B��C��D �������ʣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com