
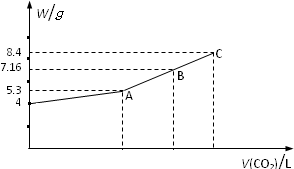
 往NaOH溶液中通入CO2气体充分反应后,在低压和低温下,小心地将溶液蒸干,得到白色的固体M,通入CO2的体积V(CO2)(标准状况)与M的质量W的关系如下图.
往NaOH溶液中通入CO2气体充分反应后,在低压和低温下,小心地将溶液蒸干,得到白色的固体M,通入CO2的体积V(CO2)(标准状况)与M的质量W的关系如下图.| 1 |
| 2 |
| 4g |
| 40g/mol |
| 1 |
| 2 |
|


 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案科目:高中化学 来源: 题型:
| A、某溶液做焰色反应,现象为黄色,说明该溶液中不存在K+ |
| B、配制950mL1mol/LNa2CO3溶液时,应用托盘天平称取100.7g无水Na2CO3 |
| C、为证明酸性H2CO3>H2SiO3,可将CO2气体通入Na2SiO3溶液中观察现象 |
| D、用酒精萃取碘水中的I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
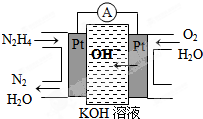

查看答案和解析>>
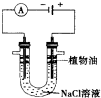
科目:高中化学 来源: 题型:
 铁是一种过渡元素,金属铁是最常用的金属.请回答下列各题:
铁是一种过渡元素,金属铁是最常用的金属.请回答下列各题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com