
 ,可通过它用不同化学反应分别制得B、C和D 三种物质.
,可通过它用不同化学反应分别制得B、C和D 三种物质.
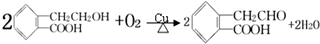 ,
,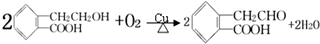 ;
; ,
, ;
; ,故答案为:
,故答案为: ;
; +2NaOH→
+2NaOH→ +HCOONa+H2O,
+HCOONa+H2O, +2NaOH→
+2NaOH→ +HCOONa+H2O.
+HCOONa+H2O.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
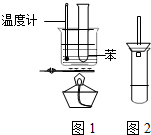 某学生为验证苯的沸点(80.1℃)比水低,设计了如图1所示的实验装置:(某些固定装置已略去)
某学生为验证苯的沸点(80.1℃)比水低,设计了如图1所示的实验装置:(某些固定装置已略去)查看答案和解析>>
科目:高中化学 来源: 题型:
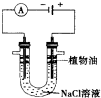 铁是一种过渡元素,金属铁是最常用的金属.请回答下列各题:
铁是一种过渡元素,金属铁是最常用的金属.请回答下列各题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,22.4LCH4中含有4 NA个共价键 |
| B、在熔融状态下,1molNaHSO4完全电离出的离子总数为3NA |
| C、5.5g超重水(T2O)中含有的中子数为3 NA |
| D、7.8gNa2O2与过量CO2反应,转移电子数为0.1NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com