
著名化学家徐光宪获得国家最高科学技术奖,以表彰他在稀土萃取理论方面作出的贡献。已知:金属铈(稀土元素)在空气中易氧化变暗,受热时燃烧,遇水很快反应。(注:铈常见的化合价为+3和+4,氧化性:Ce4+>Fe3+>I2。)下列说法正确的是
A.铈溶于氢碘酸的化学方程式可表示为:Ce + 4HI  CeI4 + 2H2↑ CeI4 + 2H2↑ |
| B.用Ce(SO4)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4+ + 2Fe2+=Ce3+ + 2Fe3+ |
| C.在一定条件下,电解熔融状态的CeO2制Ce,在阴极获得铈 |
D.铈的四种核素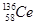 、 、 、 、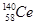 、 、 ,它们互称为同素异形体 ,它们互称为同素异形体 |
科目:高中化学 来源: 题型:单选题
工业废水中常含有一定量的Cr2O72—和CrO42—,它们会对人类及生态系统产生很大的伤害,必须进行处理。该法的工艺流程为
其中第①步存在平衡:2CrO42—(黄色)+2H+ Cr2O72—(橙色)+H2O下列说法错误的是
Cr2O72—(橙色)+H2O下列说法错误的是
| A.在第①反应平衡体系中加入水,溶液中c(H+)增大 |
| B.溶液的pH值不变时,说明第①步反应达平衡状态 |
| C.第②步中,还原0.01mol Cr2O72—离子,需要0.06mol的FeSO4·7H2O。 |
| D.上述三步转化反应中,只有一个反应为氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
1.52g铜镁合金完全溶解于50mL密度为1.40g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体N2O4的混合气体1120mL(标准状况)。向反应后的溶液中加入1.0 mol/LNaOH溶液,当金属离子全部沉淀时,得到2.54 g沉淀。下列说法不正确的是
| A.该合金中铜与镁的物质的量之比是2:l |
| B.该浓硝酸中HN03的物质的量浓度是14.0 mol/L |
| C.得到2.54 g沉淀时,加入NaOH溶液的体积是600 mL |
| D.NO2和N2O4的混合气体中,NO2的体积分数是80% |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
有Fe2+、NO3-、Fe3+、NH4+、H+和H2O六种粒子,属于同一氧化还原反应中的反应物和生成物,下列叙述不正确的是
| A.氧化剂和还原剂的物质的量之比为1∶8 |
| B.该过程说明Fe(NO3)2溶液不宜加酸酸化 |
| C.每1 mol NO3-发生氧化反应,转移8 mol e- |
| D.若把该反应设计为原电池,则负极反应为Fe2+-e-=Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
一定量的CuS和Cu2S的混合物投入足量的HNO3中,收集到气体a mol,向反应后的溶液中(存在Cu2+和SO42-)加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO固体120g,若上述气体为NO,则a可能为 mol.
| A.2.50 | B.4.00 | C.7.50 | D.3.15 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在含有Cu(NO3)2、Zn(NO3)2、Fe(NO3)3和AgNO3各0.1 mol的混合溶液中加入0.1 mol铁粉,充分搅拌后铁完全反应,且溶液中不存在Fe3+,同时又析出0.1 mol Ag。则下列结论中不正确的是( )
| A.反应后溶液中Cu2+与Fe2+的物质的量之比为1∶2 |
| B.氧化性:Ag+>Cu2+>Fe3+>Zn2+ |
| C.含Fe3+的溶液可腐蚀铜板 |
| D.1 mol Fe可还原2 mol Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
著名化学家徐光宪获得国家最高科学技术奖,以表彰他在稀土萃取理论方面作出的贡献。已知:金属铈(稀土元素在空气中易氧化变暗,受热时燃烧,遇水很快反应。(注:铈常见的化合价为+3和+4,氧化性Ce4+>Fe3+。)下列说法正确的是 ( )
| A.铈溶于氢碘酸的化学方程式可表示为:Ce+4HI=CeI4+2H2↑. |
| B.用Ce(SO4)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4++2Fe2+═Ce3++2Fe3+ |
| C.在一定条件下,电解熔融状态的CeO2制Ce,在阴极获得铈 |
| D.四种铈的核素13658Ce、13858Ce、14058Ce、14258Ce,它们互称为同素异形体 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
木炭与浓硫酸反应可表示为:C +2H2SO4(浓)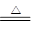 CO2↑+2SO2↑+2H2O。
CO2↑+2SO2↑+2H2O。
(1)该反应的反应物和生成物中,属于氧化物的是 。
(2)木炭作 (填“氧化剂”或“还原剂”),硫酸 (填“被氧化”或“被还原”)。
(3)若消耗了2mol H2SO4,则生成 mol SO2。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
①14Cu2++5FeS2+12H2O = 7Cu2S + 5Fe2+ + 24H++3SO42-
②Mn2+ + S2O82- + H2O— MnO4- + SO42- H+
对上述两个反应判断正确的是:
| A.①②反应中SO42—都是氧化产物 |
| B.两个反应中电子转移数目都是10mol |
| C.①反应中的硫元素既被氧化又被还原 |
| D.氧化性:MnO4—> S2O82— |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com