
ЎҫМвДҝЎҝДіОВ¶ИПВЈ¬ ·ҙУҰH2(g)+CO2(g)![]() H2O(g)+CO(g)өДЖҪәвіЈКэ
H2O(g)+CO(g)өДЖҪәвіЈКэ![]() ЎЈёГОВ¶ИПВФЪМе»эҫщОӘ10 LөДИэёцГЬұХИЭЖчЦР·ЦұрјУИл·ҙУҰОпЈ¬ЖрКјјУИлБҝИзНјЛщКҫЈәПВБРЕР¶ПІ»ХэИ·өДКЗ
ЎЈёГОВ¶ИПВФЪМе»эҫщОӘ10 LөДИэёцГЬұХИЭЖчЦР·ЦұрјУИл·ҙУҰОпЈ¬ЖрКјјУИлБҝИзНјЛщКҫЈәПВБРЕР¶ПІ»ХэИ·өДКЗ
ЖрКјБҝ | јЧ | ТТ | ұы |
H2 ЈЁmolЈ© | 1 | 2 | 2 |
CO2ЈЁmolЈ© | 1 | 1 | 2 |
A.·ҙУҰҝӘКјКұЈ¬јЧЦРөД·ҙУҰЛЩВКЧоВэЈ¬ұыЦРөД·ҙУҰЛЩВКЧоҝм
B.ЖҪәвКұЈ¬јЧәНұыЦРCO2өДЧӘ»ҜВКПаөИЈ¬ҫщКЗ60ЈҘ
C.ЖҪәвКұ,ТТЦРЈИ2өДЧӘ»ҜВКҙуУЪ60%
D.ЖҪәвКұЈ¬ұыЦРЈг(ЈИ2 ) КЗ0. 08 molЎӨL-1
Ўҫҙр°ёЎҝC
ЎҫҪвОцЎҝ
AЈ®ФЪЖдЛьМхјюІ»ұдКұЈ¬Фцҙу·ҙУҰОпөДЕЁ¶ИЈ¬·ҙУҰЛЩВКјУҝмЈ¬јхРЎ·ҙУҰОпөДЕЁ¶ИЈ¬·ҙУҰЛЩВКјхРЎЎЈУЙУЪФЪ·ҙУҰҝӘКјКұЈ¬јЧЦРОпЦКЕЁ¶ИЧоРЎЈ¬ұыЦРОпЦКЕЁ¶ИЧоҙуЈ¬ТтҙЛјЧЦРөД·ҙУҰЛЩВКЧоВэЈ¬ұыЦРөД·ҙУҰЛЩВКЧоҝмЈ¬ХэИ·Ј»
BЈ®УЙУЪёГ·ҙУҰКЗ·ҙУҰЗ°әуЖшМеМе»эПаөИөД·ҙУҰЈ¬јЧЎўұыЦРОпЦКөДЕЁ¶ИұИПаөИЈ¬ЛщТФЖҪәвКұЈ¬јЧәНұыЦРCO2өДЧӘ»ҜВКПаөИЈ¬јЩЙијЧЦРH2·ҙУҰөДОпЦКөДБҝКЗxЈ¬ФтЖҪәвКұёчОпЦКөДОпЦКөДБҝ·ЦұрКЗ:H2:((1-x)Ј¬CO2:((1-x)Ј¬H2O:xЈ»COЈәxЈ»x2/(1-x)2=9/4Ј¬ҪвөГx=0.6Ј¬ТтҙЛБҪЦЦОпЦКөДЧӘ»ҜВКҫщКЗ60ЈҘЈ¬ХэИ·Ј»
CЈ®¶ФУЪТТЈ¬УЙУЪЖдЛьМхјюІ»ұдЈ¬¶шH2ЕЁ¶ИФцҙуЈ¬ФтёщҫЭЖҪәвТЖ¶ҜФӯАнЈәФцҙу·ҙУҰОпөДЕЁ¶ИЈ¬ЖҪәвХэПтТЖ¶ҜЈ¬К№ЖдЛьОпЦКөДЧӘ»ҜВКФцҙ󣬶шёГОпЦКөДЧӘ»ҜВКҪөөНЎЈТтҙЛЖҪәвКұ, ТТЦРЈИ2өДЧӘ»ҜВКРЎУЪ60%Ј¬ҙнОуЈ»
DЈ®УЙУЪјЧЎўұыЦРОпЦКөДЧӘ»ҜВК¶јКЗ60%Ј¬ЛщТФЖҪәвКұЈ¬ұыЦРЈг(ЈИ2 ) КЗ2molЎБ40%ЎВ10L="0." 08 molЎӨL-1Ј¬ХэИ·ЎЈ


 ЕаУЕәГҫнөҘФӘјУЖЪД©ҫнПөБРҙр°ё
ЕаУЕәГҫнөҘФӘјУЖЪД©ҫнПөБРҙр°ё
| Дкј¶ | ёЯЦРҝОіМ | Дкј¶ | іхЦРҝОіМ |
| ёЯТ» | ёЯТ»Гв·СҝОіМНЖјцЈЎ | іхТ» | іхТ»Гв·СҝОіМНЖјцЈЎ |
| ёЯ¶ю | ёЯ¶юГв·СҝОіМНЖјцЈЎ | іх¶ю | іх¶юГв·СҝОіМНЖјцЈЎ |
| ёЯИэ | ёЯИэГв·СҝОіМНЖјцЈЎ | іхИэ | іхИэГв·СҝОіМНЖјцЈЎ |
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝКТОВКұЈ¬CH3COOHөДөзАлЖҪәвіЈКэОӘKЈ¬Пт20mL 0.1mol/L CH3COOHИЬТәЦРЦрөОјУИл0.1mol/L NaOHИЬТәЈ¬ЖдpHұд»ҜЗъПЯИзНјЛщКҫЈЁәцВФОВ¶Иұд»ҜЈ©ЎЈПВБРЛө·ЁЦРХэИ·өДКЗЈЁ Ј©

A. bөгұнКҫөДИЬТәЦРc(Na+)Јҫc(CH3COO©Ғ)
B. cөгұнКҫCH3COOHәНNaOHЗЎәГ·ҙУҰНкИ«
C. dөгұнКҫөДИЬТәЦРc(CH3COO©Ғ) c(H+)/c(CH3COOH)ҙуУЪK
D. bЎўcЎўdИэөгұнКҫөДИЬТәЦРТ»¶Ё¶јҙжФЪЈәc(Na+)+c(H+)ЁTc(CH3COO©Ғ)+c(OH©Ғ)
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝОТ№ъҝЖС§јТСРЦЖБЛТ»ЦЦРВРНөДёЯұИДЬБҝРҝ-өвдеТәБчөзіШЈ¬Жд№ӨЧчФӯАнКҫТвНјИзПВЎЈНјЦРЦьТәЖчҝЙҙўҙжөзҪвЦКИЬТәЈ¬МбёЯөзіШөДИЭБҝЎЈПВБРРрКцІ»ХэИ·өДКЗ
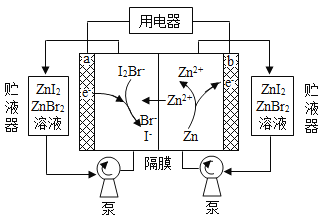
A. ·ЕөзКұЈ¬aөзј«·ҙУҰОӘ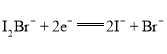
B. ·ЕөзКұЈ¬ИЬТәЦРАлЧУөДКэДҝФцҙу
C. ідөзКұЈ¬bөзј«ГҝФцЦШ![]() Ј¬ИЬТәЦРУР
Ј¬ИЬТәЦРУР![]() ұ»Сх»Ҝ
ұ»Сх»Ҝ
D. ідөзКұЈ¬aөзј«ҪУНвөзФҙёәј«
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝТСЦӘЈәKsp(AgCl)=1.8ЎБ10ЎӘ10Ј¬Ksp(AgI)=1.5ЎБ10ЎӘ16 Ј¬Ksp(Ag2CrO4)=2.0ЎБ10ЎӘ12Ј¬ФтПВБРДСИЬСОөДұҘәНИЬТәЦРЈ¬Ag+ЕЁ¶ИҙуРЎЛіРтХэИ·өДКЗ ЈЁ Ј©
A.AgCl>AgI> Ag2CrO4B.AgCl> Ag2CrO4>AgI
C.Ag2CrO4>AgI>AgClD.Ag2CrO4>AgCl>AgI
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝТСЦӘПВБРОпЦКФЪ 20 ЎжПВөД Ksp ИзПВЈ¬КФ»ШҙрПВБРОКМвЈә
»ҜС§КҪ | AgCl | AgBr | AgI | Ag2S | Ag2CrO4 |
СХЙ« | °ЧЙ« | Зі»ЖЙ« | »ЖЙ« | әЪЙ« | әмЙ« |
Ksp | 2.0ЎБ10-10 | 5.4ЎБ10-13 | 8.3ЎБ10-17 | 2.0ЎБ10-48 | 2.0ЎБ10-12 |
ЈЁ1Ј©20 ЎжКұЈ¬ЙПКцОеЦЦТшСОұҘәНИЬТәЦРЈ¬AgЈ«ОпЦКөДБҝЕЁ¶ИУЙҙуөҪРЎөДЛіРтКЗ_______ЈЁУГ»ҜС§КҪұнКҫЈ©ЎЈ
ЈЁ2Ј©ПтөИЕЁ¶ИөД KCl әН KBr өД»мәПИЬТәЦРЦрҪҘјУИл AgNO3 ИЬТәЈ¬өұБҪЦЦіБөн№ІҙжКұЈ¬![]() ЈҪ__________ЎЈ
ЈҪ__________ЎЈ
ЈЁ3Ј©Ів¶ЁЛ®ЦР Cl-ә¬БҝКұЈ¬іЈУГ AgЈ«ҪшРРөО¶ЁЈ¬өО¶ЁКұЈ¬УҰјУИлөДЦёКҫјБКЗ_____ЎЈ
AЈ®KBr BЈ®KI CЈ®K2S DЈ®K2CrO4
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝФӯөзіШФӯАнөД·ўПЦКЗҙўДЬәН№©ДЬјјКхөДҫЮҙуҪшІҪЈ¬КЗ»ҜС§¶ФИЛАаөДТ»ПоЦШҙу№ұПЧЎЈ
(1)ПЦУРИзПВБҪёц·ҙУҰЈәA.NaOHЈ«HCl=NaClЈ«H2OЈ»B.ZnЈ«H2SO4=ZnSO4Ј«H2ЎьЎЈЙПКц·ҙУҰЦРДЬЙијЖіЙФӯөзіШөДКЗ______(МоЧЦДёҙъәЕ)Ј¬ёәј«Zn·ўЙъБЛ_____·ҙУҰ(МоЎ°Сх»ҜЎұ»тЎ°»№ФӯЎұ)ЎЈ
(2)Ҫ«ҙҝРҝЖ¬әНҙҝНӯЖ¬°ҙИзНјЛщКҫ·ҪКҪІеИл100 mLПаН¬ЕЁ¶ИөДПЎБтЛбЦРТ»¶ОКұјдЈ¬»ШҙрПВБРОКМвЈә

ўЩПВБРЛө·ЁХэИ·өДКЗ_______(МоЧЦДёҙъәЕ)ЎЈ
AЈ®јЧЎўТТҫщОӘ»ҜС§ДЬЧӘұдОӘөзДЬөДЧ°ЦГ BЈ®ТТЦРНӯЖ¬ЙПГ»УРГчПФұд»Ҝ
CЈ®јЧЦРНӯЖ¬ЦКБҝјхЙЩЎўТТЦРРҝЖ¬ЦКБҝјхЙЩ DЈ®БҪЙХұӯЦРИЬТәөДpHҫщФцҙу
ўЪФЪПаН¬КұјдДЪЈ¬БҪЙХұӯЦРІъЙъЖшЕЭөДЛЩ¶ИЈәјЧ______ТТ(МоЎ°ЈҫЎұЎўЎ°ЈјЎ°»тЎ°ЈҪЎұ)ЎЈ
ўЫЗлРҙіцНјЦР№№іЙФӯөзіШөДЧ°ЦГёәј«өДөзј«·ҙУҰКҪ___________ЎЈ
ўЬөұТТЦРІъЙъ1.12 L(ұкЧјЧҙҝц)ЖшМеКұЈ¬Ҫ«РҝЎўНӯЖ¬ИЎіцЈ¬ФЩҪ«ЙХұӯЦРөДИЬТәПЎКНЦБ1 LЈ¬ІвөГИЬТәЦРc(HЈ«)ЈҪ0.1 molЎӨLЈӯ1(Йи·ҙУҰЗ°әуИЬТәМе»эІ»ұд)ЎЈКФИ·¶ЁФӯПЎБтЛбөДОпЦКөДБҝЕЁ¶ИОӘ_______
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝДіОВ¶ИПВЈ¬ФЪТ»ёц2 LөДГЬұХИЭЖчЦРЈ¬јУИл4 mol AәН2 mol B·ўЙъ·ҙУҰЈә
3A(g)Ј«2B(g)![]() 4C(s)Ј«2D(g)Ј¬5minәуҙпөҪЖҪәвЈ¬ІвөГЙъіЙ1.6 mol CЈ¬ФтПВБРЛө·ЁХэИ·өДКЗ
4C(s)Ј«2D(g)Ј¬5minәуҙпөҪЖҪәвЈ¬ІвөГЙъіЙ1.6 mol CЈ¬ФтПВБРЛө·ЁХэИ·өДКЗ
A. ёГ·ҙУҰөД»ҜС§ЖҪәвіЈКэұнҙпКҪКЗKЈҪ![]()
B. ҙЛКұЈ¬BөДЖҪәвЧӘ»ҜВККЗ40%
C. ФцҙуёГМеПөөДС№ЗҝЈ¬ЖҪәвПтУТТЖ¶ҜЈ¬»ҜС§ЖҪәвіЈКэФцҙу
D. ИфПтЖҪәвМеПөЦРјУИлЙЩБҝCЈ¬ФтХэЎўДж·ҙУҰЛЩВКҫщФцҙу
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝФЪәгОВМхјюПВЈ¬Ҫ«Т»¶ЁБҝ![]() әН
әН![]() өД»мәПЖшМеНЁИлТ»ИЭ»эОӘ2LөДГЬұХИЭЖчЦРЈ¬ІвөГёчОпЦКөДЕЁ¶ИЛжКұјдұд»Ҝ№ШПөИзНјЛщКҫЈ®ПВБРЛө·ЁХэИ·өДКЗ
өД»мәПЖшМеНЁИлТ»ИЭ»эОӘ2LөДГЬұХИЭЖчЦРЈ¬ІвөГёчОпЦКөДЕЁ¶ИЛжКұјдұд»Ҝ№ШПөИзНјЛщКҫЈ®ПВБРЛө·ЁХэИ·өДКЗ![]()
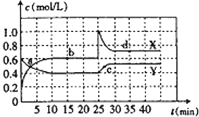
A.НјЦРөДБҪМхЗъПЯЦРЈ¬YКЗұнКҫ![]() ЕЁ¶ИЛжКұјдөДұд»ҜЗъПЯ
ЕЁ¶ИЛжКұјдөДұд»ҜЗъПЯ
B.З°10minДЪЈ¬УГ![]() ұнКҫөД»ҜС§·ҙУҰЛЩВКОӘ
ұнКҫөД»ҜС§·ҙУҰЛЩВКОӘ![]()
C.ФЪ25minКұЈ¬·ҙУҰёДұдөДМхјюКЗФцҙуБЛ![]() өДЕЁ¶И
өДЕЁ¶И
D.aЎўbЎўcЎўdЛДёцөгЦРЈ¬УРaЎўbЎўdөгөД»ҜС§·ҙУҰҙҰУЪЖҪәвЧҙМ¬
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝH2C2O4Л®ИЬТәЦРІҝ·ЦОўБЈөД·ЦІј·ЦКэҰДУлpH№ШПөИзНјЛщКҫЈ¬ПВБРЛө·ЁХэИ·өДКЗ

A.ПтH2C2O4ИЬТәЦРөОјУNaOHИЬТәЦБpHЈҪ2.5Јәc(H2C2O4)Ј«c(C2O42Јӯ)>c(HC2O4Јӯ)
B.УЙНјҝЙЦӘЈәH2C2O4өДKa2ЈҪ10Јӯ4.2
C.ПтH2C2O4ИЬТәЦРөОјУNaOHИЬТәЦБpHЈҪ7Ј¬ФтИЬТәЦРЈә2c(C2O42Јӯ)>c(NaЈ«)
D.Ҫ«0.01 molЎӨLЈӯ1өДH2C2O4ИЬТәУл0.02 molЎӨLЈӯ1 NaOHИЬТәөИМе»э»мәПәуөДИЬТәЦРЈәc(OHЈӯ)ЈҪc(HЈ«)Ј«c(HC2O4Јӯ)Ј«2c(H2C2O4)
Ійҝҙҙр°ёәНҪвОц>>
№ъјКѧУУЕСЎ - Б·П°ІбБРұн - КФМвБРұн
әюұұКЎ»ҘБӘНшОҘ·ЁәНІ»БјРЕПўҫЩұЁЖҪМЁ | НшЙПУРәҰРЕПўҫЩұЁЧЁЗш | өзРЕХ©ЖӯҫЩұЁЧЁЗш | ЙжАъК·РйОЮЦчТеУРәҰРЕПўҫЩұЁЧЁЗш | ЙжЖуЗЦИЁҫЩұЁЧЁЗш
ОҘ·ЁәНІ»БјРЕПўҫЩұЁөз»°Јә027-86699610 ҫЩұЁУКПдЈә58377363@163.com