
【题目】已知:Ksp(AgCl)=1.8×10—10,Ksp(AgI)=1.5×10—16 ,Ksp(Ag2CrO4)=2.0×10—12,则下列难溶盐的饱和溶液中,Ag+浓度大小顺序正确的是 ( )
A.AgCl>AgI> Ag2CrO4B.AgCl> Ag2CrO4>AgI
C.Ag2CrO4>AgI>AgClD.Ag2CrO4>AgCl>AgI
科目:高中化学 来源: 题型:
【题目】下列有关化学反应方向及其判据的说法中错误的是( )
A.1molH2O在不同状态时的熵值:S[H2O(s)]<S[H2O(g)]
B.自发进行的反应一定能迅速进行
C.CaCO3(s)![]() CaO(s)+CO2(g)△H>0能否自发进行与温度有关
CaO(s)+CO2(g)△H>0能否自发进行与温度有关
D.常温下,反应C(s)+CO2(g)=2CO(g)不能自发进行,则该反应的△H>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向密闭容器中充入CO和![]() 各
各![]() mol,一定温度下发生反应:
mol,一定温度下发生反应:![]() ,下列叙述正确的是
,下列叙述正确的是
A.如果容器内压强不再改变,则证明该反应已达到平衡状态
B.寻找合适的催化剂是加快反应速率并提高![]() 产率的有效措施
产率的有效措施
C.当反应达到平衡后,保持容器内体积不变,再向其中充入CO和![]() 各1mol,达到新的平衡后
各1mol,达到新的平衡后![]() 的产率会增大
的产率会增大
D.如果在某温度下平衡常数为![]() ,则平衡时CO转化率为
,则平衡时CO转化率为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用CO合成甲醇(CH3OH)的化学方程式为CO(g)+2H2(g)CH3OH(g) △H<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是( )
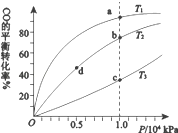
A.温度:T1>T2>T3
B.正反应速率:v(b)>v(d) v(a)>v(c)
C.平衡常数:K(a)>K(c) K(b)=K(d)
D.平均摩尔质量:M(b)>M(d) M(a)<M(c)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】开发新能源是解决环境污染的重要举措,其中甲醇、甲烷是优质的清洁燃料,可制作燃料电池.
![]() 已知:①
已知:①![]()
②![]()
③![]() .
.
甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为 ______ .
![]() 生产甲醇的原料CO和
生产甲醇的原料CO和![]() 可由反应
可由反应![]() 得到.
得到.
①一定条件下![]() 的平衡转化率与温度、压强的关系如图
的平衡转化率与温度、压强的关系如图![]() 则
则![]() ______
______ ![]() 填“
填“![]() ”、“
”、“![]() ”或“
”或“![]() ”,下同
”,下同![]() 、B、C三点处对应平衡常数
、B、C三点处对应平衡常数![]() 、
、![]() 、
、![]() 的大小顺序为 ______ .
的大小顺序为 ______ .
②![]() 时,将
时,将![]() 和
和![]() 通入容积为1L的定容密闭容器中发生反应,能说明该反应已经达到平衡状态的是 ______
通入容积为1L的定容密闭容器中发生反应,能说明该反应已经达到平衡状态的是 ______ ![]() 填序号
填序号![]() .
.
![]() .容器的压强恒定
.容器的压强恒定
![]() .容器内气体密度恒定
.容器内气体密度恒定
![]() 正
正![]() 逆
逆![]()
![]() 单位时间内消耗
单位时间内消耗![]() 同时生成
同时生成![]()
![]() 甲醇燃料电池
甲醇燃料电池![]() 简称
简称![]() 由于结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注.DMFC工作原理如图2所示:通入a气体的电极是原电池的 ______ 极
由于结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注.DMFC工作原理如图2所示:通入a气体的电极是原电池的 ______ 极![]() 填“正”或“负”
填“正”或“负”![]() ,其电极反应式为 ______ .
,其电极反应式为 ______ .
![]() 某研究小组将两个甲烷燃料电池串联后作为电源,进行饱和氯化钠溶液电解实验,如图3所示U形管中氯化钠溶液的体积为
某研究小组将两个甲烷燃料电池串联后作为电源,进行饱和氯化钠溶液电解实验,如图3所示U形管中氯化钠溶液的体积为![]() 闭合K后,若每个电池甲烷用量均为
闭合K后,若每个电池甲烷用量均为![]() 标况
标况![]() ,且反应完全,则理论上通过电解池的电量为 ______
,且反应完全,则理论上通过电解池的电量为 ______ ![]() 列式计算.法拉第常数
列式计算.法拉第常数![]() ,若产生的气体全部逸出,电解后溶液混合均匀,电解后U形管中溶液的pH为 ______ .
,若产生的气体全部逸出,电解后溶液混合均匀,电解后U形管中溶液的pH为 ______ .

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有常温条件下甲、乙、丙三种溶液,甲为 0.1 mol·L-1 的 NaOH 溶液, 乙为 0.1 mol·L-1 的 HCl 溶液,丙为 0.1 mol·L-1 的 CH3COOH 溶液,试回答下列问题:
(1)甲溶液的 pH=_____。
(2)丙溶液中存在的电离平衡为_____(用电离方程式表示)。
(3)甲、乙、丙三种溶液中由水电离出的 c(OH-)的大小关系为 _____。
A. 甲=乙=丙 B. 甲=乙>丙 C.甲=乙<丙 D.无法判断
(4)某同学用甲溶液分别滴定 20.00 mL 乙溶液和 20.00 mL 丙溶液,得到如图所示两 条滴定曲线,请完成有关问题:
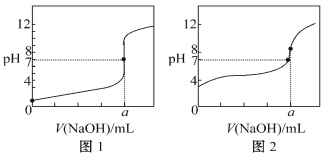
①甲溶液滴定丙溶液的曲线是_____(填“图 1”或“图 2”);
②a=_____mL。
(5)将等体积的甲溶液和丙溶液混合后,溶液呈_____(填“酸性”、“中性”或 “碱性”)。溶液中离子浓度大小顺序为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下, 反应H2(g)+CO2(g)![]() H2O(g)+CO(g)的平衡常数
H2O(g)+CO(g)的平衡常数![]() 。该温度下在体积均为10 L的三个密闭容器中分别加入反应物,起始加入量如图所示:下列判断不正确的是
。该温度下在体积均为10 L的三个密闭容器中分别加入反应物,起始加入量如图所示:下列判断不正确的是
起始量 | 甲 | 乙 | 丙 |
H2 (mol) | 1 | 2 | 2 |
CO2(mol) | 1 | 1 | 2 |
A.反应开始时,甲中的反应速率最慢,丙中的反应速率最快
B.平衡时,甲和丙中CO2的转化率相等,均是60%
C.平衡时,乙中H2的转化率大于60%
D.平衡时,丙中c(H2 ) 是0. 08 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温条件下,往容积为2L的密闭容器内加入0.4mol的N2和1.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)2NH3(g),反应中NH3物质的量变化情况如图:下列说法不合理的是
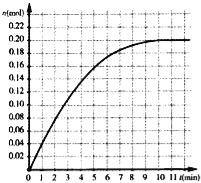
A.其它条件不变,若改用5L容器达到平衡需要的时间将大于10min
B.N2平衡转化率为25%
C.平衡时气体总压强为开始时的90%
D.反应前10min反应速率v(H2)=0.01molL﹣1min﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,水溶液中H+和OH-的浓度变化曲线如图,下列说法正确的是( )

A.升高温度,可能引起由c向b的变化
B.该温度下,水的离子积常数为1.0×10-13
C.该温度下,通入HCl可能引起由b向a的变化
D.该温度下,稀释溶液可能引起由c向d的变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com