
【题目】现有常温条件下甲、乙、丙三种溶液,甲为 0.1 mol·L-1 的 NaOH 溶液, 乙为 0.1 mol·L-1 的 HCl 溶液,丙为 0.1 mol·L-1 的 CH3COOH 溶液,试回答下列问题:
(1)甲溶液的 pH=_____。
(2)丙溶液中存在的电离平衡为_____(用电离方程式表示)。
(3)甲、乙、丙三种溶液中由水电离出的 c(OH-)的大小关系为 _____。
A. 甲=乙=丙 B. 甲=乙>丙 C.甲=乙<丙 D.无法判断
(4)某同学用甲溶液分别滴定 20.00 mL 乙溶液和 20.00 mL 丙溶液,得到如图所示两 条滴定曲线,请完成有关问题:
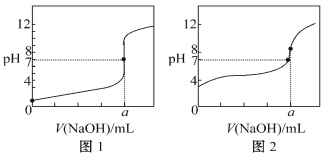
①甲溶液滴定丙溶液的曲线是_____(填“图 1”或“图 2”);
②a=_____mL。
(5)将等体积的甲溶液和丙溶液混合后,溶液呈_____(填“酸性”、“中性”或 “碱性”)。溶液中离子浓度大小顺序为_________。
【答案】13 CH3COOH![]() CH3COO-+H+、H2O
CH3COO-+H+、H2O![]() OH-+H+ C 图2 20.00 碱 c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
OH-+H+ C 图2 20.00 碱 c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
【解析】
(1)0.1molL-1的NaOH溶液中c(OH-)=0.1mol/L,根据Kw=c(H+)c(OH-)计算溶液中c(H+),再根据pH=-lgc(H+)计算溶液的pH值;
(2)溶液中存在电离平衡,应存在弱电解质;
(3)酸或碱抑制水电离,含有弱根离子的盐促进水电离;
(4)①乙酸为弱电解质,滴定终点时,溶液呈碱性;
②NaOH和乙酸恰好反应时,消耗20mlNaOH溶液,生成弱酸强碱盐,溶液呈碱性;
(5)将等体积等浓度的NaOH溶液和CH3COOH溶液混合后,恰好生成CH3COONa,CH3COO-水解使所得溶液显碱性,再结合电荷守恒判断离子浓度大小。
(1)0.1molL-1的NaOH溶液中c(OH-)=0.1mol/L,故溶液中c(H+)=![]() mol/L=10-13mol/L,故该溶液的pH=-lg10-13=13;
mol/L=10-13mol/L,故该溶液的pH=-lg10-13=13;
(2)0.1molL-1的CH3COOH溶液中存在溶剂水、水为弱电解质,溶质乙酸为弱电解质,存在电离平衡为CH3COOH![]() CH3COO-+H+、H2O
CH3COO-+H+、H2O![]() OH-+H+;
OH-+H+;
(3)酸或碱抑制水电离,含有弱根离子的盐促进水电离,乙酸是弱电解质,氢氧化钠、氯化氢是强电解质,所以相同物质的量浓度的乙酸和盐酸和氢氧化钠,盐酸中水电离出的氢氧根离子浓度小于醋酸,相同物质的量浓度的盐酸和氢氧化钠对水电离抑制程度相等,盐酸中水电离出的氢氧根离子浓度等于氢氧化钠溶液中水的电离,所以水电离出氢氧根离子浓度大小顺序是:丙>甲=乙,故答案为C;
(4)①醋酸为弱电解质,滴定过程中pH变化较盐酸缓慢,滴定终点时溶液呈碱性,则滴定醋酸溶液的曲线是图2;
②滴定终点时n(CH3COOH)=n(NaOH),则a=20.00mL,反应生成了醋酸钠,醋酸根离子发生水解,CH3COO-+H2O![]() CH3COOH+OH-,溶液显示碱性pH>7;
CH3COOH+OH-,溶液显示碱性pH>7;
(5)将等体积等浓度的NaOH溶液和CH3COOH溶液混合后,恰好生成CH3COONa,CH3COO-水解使所得溶液显碱性,即c(OH-)>c(H+);,溶液中存在的电荷守恒式为c(CH3COO-)+ c(OH-)=c(Na+)+c(H+);,则c(CH3COO-)<c(Na+),故所得溶液中各离子浓度由大到小的顺序为c(Na+)>c(CH3COO-)>c(OH-)>c(H+)。


 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源: 题型:
【题目】I、如图所示,X是一种生活中常见的金属元素,A、B、C、D为石墨电极,E、F分别为短周期相邻两种活泼金属中的一种,且E能与NaOH溶液反应。按图示接通线路,反应一段时间(实验中所有溶液均足量)。

(1)甲池是___(填“原电池”或“电解池”,下同]装置;乙池是___装置。
(2)D极为___(填“阴极”或“阳极”)。
(3)烧杯中溶液会变蓝的是_______(填“a”或“b”);C极上的电极反应式为____。
(4)F极上的电极反应式为:____。
(5)当电路中通过0.02mol电子时,B电极上沉积0.64g金属X,则X为___(填元素符号),甲池中反应的化学方程式为___。
II、(1)从辉铜矿中浸取铜元素,可用FeCl3作浸取剂。
①反应Cu2S+4FeCl3=2CuCl2+4FeCl2+S,每生成1molCuCl2,反应中转移电子的数目为____;浸取时,在有氧环境下可维持Fe3+较高浓度。有关反应的离子方程式是___。
②浸取过程中加入洗涤剂溶解硫时,铜元素的浸取率的变化见如图1。其原因是___。

③353K时,向FeCl3浸取液中加入CuCl2,能加快铜元素的浸取速率,其反应原理可用化学方程式表示为:___,CuCl+FeCl3=CuCl2+FeCl2。
(2)辉铜矿可由黄铜矿(主要成分为CuFeS2)通过电化学反应转变而成,有关转化见如图2。转化时正极的电极反应式为___。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 时,在
时,在![]() 的密闭容器中充入
的密闭容器中充入![]() 和
和![]() ,一定条件下发生反应:
,一定条件下发生反应:![]() ,测得
,测得![]() 和
和![]() 的浓度随时间变化如下表所示。下列说法不正确的是
的浓度随时间变化如下表所示。下列说法不正确的是
时间 |
|
|
|
| 6 | 0 | ? |
| 3 | 1 |
|
A.![]() 时间内
时间内![]()
B.![]() 时,若升高温度或再充入
时,若升高温度或再充入![]() 气体,都可以提高
气体,都可以提高![]() 的转化率
的转化率
C.![]() 时,
时,![]() 正
正![]() 逆
逆![]()
D.![]() 时,平衡常数
时,平衡常数![]() ,
,![]() 与
与![]() 的转化率相等
的转化率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷是一种重要的化工原料和清洁能源,研究其再生及合理利用有重要意义。请回答:
(1)已知一定条件下发生如下反应:CO2(g)+2H2O(g)![]() CH4(g)+2O2(g) △H=+802kJ·mol-1。将一定量的CO2(g)和H2O(g)充入10L密闭容器中,分别在催化剂M、N的作用下发生上述反应,CH4(g)的产量(n)与光照时间(t)和温度(T)变化的关系如图1所示。
CH4(g)+2O2(g) △H=+802kJ·mol-1。将一定量的CO2(g)和H2O(g)充入10L密闭容器中,分别在催化剂M、N的作用下发生上述反应,CH4(g)的产量(n)与光照时间(t)和温度(T)变化的关系如图1所示。
①若甲烷的燃烧热(△H)为-890kJ·mol-1,则水的汽化热△H=________。(汽化热指1mol液体转化为气体时吸收的热量)
②T1℃、催化剂M作用下,0--20h内该反应速率v(H2O)=_______。

③根据图1判断,催化剂的催化效果:M________N(填“强于”或“弱于”)。
(2)甲烷可用于制备合成气:CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H。将CH4(g)和H2O(g)物质的量之比为1:3充入盛有催化剂的刚性容器中发生该反应。相同时间段内测得CO的体积分数(
CO(g)+3H2(g) △H。将CH4(g)和H2O(g)物质的量之比为1:3充入盛有催化剂的刚性容器中发生该反应。相同时间段内测得CO的体积分数(![]() )与温度(T)的关系如图2所示。
)与温度(T)的关系如图2所示。
①T0℃时,CO的体积分数最大的原因为__________。
②若T0℃时,容器内起始压强为p0,CO的平衡体积分数为10%,则反应的平衡常数Kp=____(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:Ksp(AgCl)=1.8×10—10,Ksp(AgI)=1.5×10—16 ,Ksp(Ag2CrO4)=2.0×10—12,则下列难溶盐的饱和溶液中,Ag+浓度大小顺序正确的是 ( )
A.AgCl>AgI> Ag2CrO4B.AgCl> Ag2CrO4>AgI
C.Ag2CrO4>AgI>AgClD.Ag2CrO4>AgCl>AgI
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH=-41kJ·mol-1。相同温度下,在容积相同的两个恒温密闭容器中,加入一定量的反应物发生反应。相关数据如下:
CO2(g)+H2(g) ΔH=-41kJ·mol-1。相同温度下,在容积相同的两个恒温密闭容器中,加入一定量的反应物发生反应。相关数据如下:
容器编号 | 起始时各物质物质的量/mol | 达平衡过程体系能量的变化 | |||
CO | H2O | CO2 | H2 | ||
① | 1 | 4 | 0 | 0 | 放出热量:32.8kJ |
② | 0 | 0 | 1 | 4 | 热量变化:QkJ |
下列说法中,不正确的是( )
A.容器①中反应达平衡时,CO的转化率为80%
B.容器①中CO的转化率等于容器②中CO2的转化率
C.平衡时,两容器中CO2的浓度相等
D.容器①时CO的反应速率等于H2O的反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献。
(1)现有如下两个反应:A.NaOH+HCl=NaCl+H2O;B.Zn+H2SO4=ZnSO4+H2↑。上述反应中能设计成原电池的是______(填字母代号),负极Zn发生了_____反应(填“氧化”或“还原”)。
(2)将纯锌片和纯铜片按如图所示方式插入100 mL相同浓度的稀硫酸中一段时间,回答下列问题:

①下列说法正确的是_______(填字母代号)。
A.甲、乙均为化学能转变为电能的装置 B.乙中铜片上没有明显变化
C.甲中铜片质量减少、乙中锌片质量减少 D.两烧杯中溶液的pH均增大
②在相同时间内,两烧杯中产生气泡的速度:甲______乙(填“>”、“<“或“=”)。
③请写出图中构成原电池的装置负极的电极反应式___________。
④当乙中产生1.12 L(标准状况)气体时,将锌、铜片取出,再将烧杯中的溶液稀释至1 L,测得溶液中c(H+)=0.1 mol·L-1(设反应前后溶液体积不变)。试确定原稀硫酸的物质的量浓度为_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在室温时纯水中存在电离平衡:H2O![]() H++OH-。下列叙述正确的是( )
H++OH-。下列叙述正确的是( )
A. 向水中加入少量NH4Cl,由水电离出的c(H+)>1×10-7mol/L
B. 升高温度,水的电离程度增大,c(H+)增大,pH<7,所以溶液显酸性
C. 向水中加入氨水,平衡逆向移动,水的电离受到抑制,所以c(OH-)降低
D. 向水中加入少量硫酸,c(H+)增大,所以由水电离出的c(H+)>1×10-7mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在t℃时,Ag2CrO4(橘红色)在水溶液中的沉淀溶解平衡曲线如图所示.又知AgCl的Ksp=1.8×10-10。下列说法不正确的是( )

A. t℃时,Y点和Z点时Ag2CrO4的Ksp相等
B. 饱和Ag2CrO4溶液中加入K2CrO4不能使溶液由Y点变为X点
C. t℃时,Ag2CrO4的Ksp为1×10-8
D. t℃时,将0.01mol·L-1 AgNO3溶液滴入20mL0.01mol·L-1 KCl和0.01mol·L-1 K2CrO4的混合溶液中,Cl-先沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com