
室温下,下列溶液中粒子浓度关系正确的是( )
A.Na2S溶液:c(Na+)>c(HS-)>c(OH-)>c(H2S)
B.Na2C2O4溶液:c(OH-)=c(H+)+c(HC2O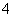 )+2c(H2C2O4)
)+2c(H2C2O4)
C.Na2CO3溶液:c(Na+)+c(H+)=2c(CO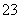 )+c(OH-)
)+c(OH-)
D.CH3COONa和CaCl2混合溶液:c(Na+)+c(Ca2+)=c(CH3COO-)+c(CH3COOH)+2c(Cl-)
B [解析] 在Na2S溶液中存在H2O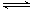
 OH-+H+以及S2-+H2O
OH-+H+以及S2-+H2O HS-+OH-、HS-+H2O
HS-+OH-、HS-+H2O H2S+OH-,溶液中粒子浓度关系为c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H2S)>c(H+),A项错误;利用质子守恒知Na2C2O4溶液中存在c(OH-)=c(H+)+c(HC2O
H2S+OH-,溶液中粒子浓度关系为c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H2S)>c(H+),A项错误;利用质子守恒知Na2C2O4溶液中存在c(OH-)=c(H+)+c(HC2O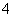 )+2c(H2C2O4),B项正确;利用电荷守恒知Na2CO3溶液中,c(Na+)+c(H+)=2c(CO
)+2c(H2C2O4),B项正确;利用电荷守恒知Na2CO3溶液中,c(Na+)+c(H+)=2c(CO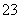 )+c(HCO
)+c(HCO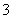 )+c(OH-),C项错误;利用原子守恒可知CH3COONa和CaCl2的混合液中c(Na+)+c(Ca2+)=c(CH3COOH)+c(CH3COO-)+
)+c(OH-),C项错误;利用原子守恒可知CH3COONa和CaCl2的混合液中c(Na+)+c(Ca2+)=c(CH3COOH)+c(CH3COO-)+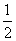 c(Cl-),D项错误。
c(Cl-),D项错误。


 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:
下列仪器:①容量瓶,②蒸馏烧瓶,③漏斗,④燃烧匙,⑤天平,⑥分液漏斗,⑦胶头滴管常用于混合物质分离的是
A.①③⑤ B.②④⑦
C.①②⑥ D.②③⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中元素A、E的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属材料。下列说法正确的是( )
A. 元素A、B组成的化合物常温下一定呈气态
B.元素C、D的最高价氧 化对应的水化物之间不能发生反应
化对应的水化物之间不能发生反应
C. 化合物AE与CE含有相同类型的化学键
化合物AE与CE含有相同类型的化学键
D. 工业上常用电解法制备元素C、D的单质
查看答案和解析>>
科目:高中化学 来源: 题型:
次磷酸(H3PO2)是一种精细磷化工产品,具有较强还原性。回答下列问题:
(1)H3PO2是一种中强酸,写出其电离方程式:_____________________________
________________________________________________________________________。
(2)H3PO2及NaH2PO2均可将溶液中的Ag+还原为银,从而可用于化学镀银。
①H3PO2中,P元素的化合价为________。
②利用H3PO2进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4∶1,则氧化产物为________(填化学式)。
③NaH2PO2为________(填“正盐”或“酸式盐”),其溶液显________(填“弱酸性”“中性”或“弱碱性”)。
(3)H3PO2的工业制法是:将白磷(P4)与Ba(OH)2溶液反应生成PH3气体和Ba(H2PO2)2,后者再与H2SO4反应。写出白磷与Ba(OH)2溶液反应的化学方程式:____________________________________________。
(4)H3PO2也可用电渗析法制备,“四室电渗析法”工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过):
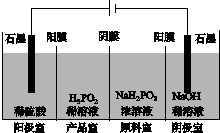
①写出阳极的电极反应式:_________________________________________。
②分析产品室可得到H3PO2的原因:_____________________________________
________________________________________________________________________。
③早期采用“三室电渗析法”制备H3PO2:将“四室电渗析法”中阳极室的稀硫酸用H3PO2稀溶液代替,并撤去阳极室与产品室之间的阳膜,从而合并了阳极室与产品室。其缺点是产品中混有________杂质,该杂质产生的原因是________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关电解质溶液中粒子浓度关系正确的是( )
A.pH=1的NaHSO4溶液:
c(H+)=c(SO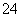 )+c(OH-)
)+c(OH-)
B.含有AgCl和AgI固体的悬浊液:
c(Ag+)>c(Cl-)=c(I-)
C.CO2的水溶液:c(H+)>c(HCO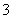 )=2c(CO
)=2c(CO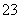 )
)
D.含等物质的量的NaHC2O4和Na2C2O4的溶液:3c(Na+)=2[c(HC2O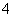 )+c(C2O
)+c(C2O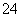 )+c(H2C2O4)]
)+c(H2C2O4)]
查看答案和解析>>
科目:高中化学 来源: 题型:
化学与社会、生活密切相关。对下列现象或事实的解释正确的是( )
| 选项 | 现象或事实 | 解释 |
| A. | 用热的纯碱溶液洗去油污 | Na2CO3可直接与油污反应 |
| B. | 源白粉在空气中久置变质 | 漂白粉中的CaCl2与空气中的CO2反应生成CaCO3 |
| C. | 施肥时,草木灰(有效成分为K2CO3)不能与NH4Cl混合使用 | K2CO3与HN4Cl反应生成氨气会降低肥效 |
| D. | FeCl3溶液可用于铜质印刷线路板制作 | FeCl3能从含Cu2+的溶液中置换出铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是( )
A.浓氨水中滴加FeCl3饱和溶液可制得Fe(OH)3胶体
B.CH3COONa溶液中滴加少量浓盐酸后c(CH3COO-)增大
C.Ca(HCO3)2溶液与过量NaOH溶液反应可得到Ca(OH)2
D.25 ℃时Cu(OH)2在水中的溶解度大于其在Cu(NO3)2溶液中的溶解度
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关物质的性质与应用不相对应的是( )
A.明矾能水解生成Al(OH)3胶体,可用作净水剂
B.FeCl3溶液能与Cu反应,可用于蚀刻印刷电路
C.SO2具有氧化性,可用于漂白纸浆
D.Zn具有还原性和导电性,可用作锌锰干电池的负极材料
查看答案和解析>>
科目:高中化学 来源: 题型:
二氧化硫和氮的氧化物是常用的化工原料,但也是大气的主要污染物。综合治理其污染是坏境化学当前的重要研究内容之一。
(1)硫酸生产中,SO2催化氧化生成SO3:
2SO2(s)+O2(g) 2SO3(g).
2SO3(g).
某温度下,SO2的平衡转化率(α)与体系总压强(P)的关系如下图所示。根据 图示回答下列问题:
图示回答下列问题:
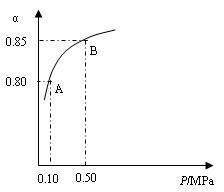
①将2.0 molSO2和1.0molO2置于10 L密闭容器中,反应达平衡后,体系总压强为0.10MPa。该反应的平衡常数等于__________。
②平衡状态由A变到B时,平衡常数K(A)_______K(B)(填“>”、“<”或“=”)。
(2)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ·mol-1
若用标准状况下4.48  L CH4还原NO2至N2,整个过程中转移的电子
L CH4还原NO2至N2,整个过程中转移的电子 总数为__________(阿伏加德罗常数的值用NA表示),放出的热量为___________kJ。
总数为__________(阿伏加德罗常数的值用NA表示),放出的热量为___________kJ。
(3)新型纳米材料氧缺位铁酸盐(MFe2Ox,3<x<4,M=Mn、Co、Zn或Ni)由铁酸盐(MFe2O4)经高温还原而得,常温下,它能使工业废气中的酸性氧化物分解除去。转化流程如图所示:
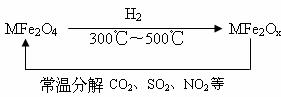
请写出MFe2Ox分解SO2的化学方程式________________(不必配平)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com