
二氧化硫和氮的氧化物是常用的化工原料,但也是大气的主要污染物。综合治理其污染是坏境化学当前的重要研究内容之一。
(1)硫酸生产中,SO2催化氧化生成SO3:
2SO2(s)+O2(g) 2SO3(g).
2SO3(g).
某温度下,SO2的平衡转化率(α)与体系总压强(P)的关系如下图所示。根据 图示回答下列问题:
图示回答下列问题:
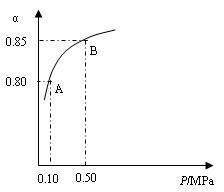
①将2.0 molSO2和1.0molO2置于10 L密闭容器中,反应达平衡后,体系总压强为0.10MPa。该反应的平衡常数等于__________。
②平衡状态由A变到B时,平衡常数K(A)_______K(B)(填“>”、“<”或“=”)。
(2)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ·mol-1
若用标准状况下4.48  L CH4还原NO2至N2,整个过程中转移的电子
L CH4还原NO2至N2,整个过程中转移的电子 总数为__________(阿伏加德罗常数的值用NA表示),放出的热量为___________kJ。
总数为__________(阿伏加德罗常数的值用NA表示),放出的热量为___________kJ。
(3)新型纳米材料氧缺位铁酸盐(MFe2Ox,3<x<4,M=Mn、Co、Zn或Ni)由铁酸盐(MFe2O4)经高温还原而得,常温下,它能使工业废气中的酸性氧化物分解除去。转化流程如图所示:
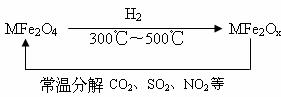
请写出MFe2Ox分解SO2的化学方程式________________(不必配平)。
【答案】
(1)①800L·mol-1
②=
(2)1.60NA(或1.6NA)
173.4
(3)MFe2Ox+SO2→MFe2O4+S

(1)0.10 MPa时:c(SO2)=2 mol×(1-0.8)×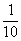 =0.04 mol·L-1
=0.04 mol·L-1
c(O2)=(1 mol-1.6 mol×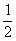 )×
)×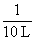 =0.02 mol·L-1
=0.02 mol·L-1
c(SO3)=1.6 mol×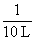 =0.16 mol·L-1
=0.16 mol·L-1
K=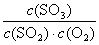 =
=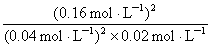 =800 L·mol-1
=800 L·mol-1
②由A到B,温度不变,只增大压强,K不变。
(2)本小题是有关氧化还原和反应热的计算 ,由盖斯定律把两式相加,得2CH4(g)+4NO2(g)===2N2(g)+2CO2(g)+4H2O(g) ΔH=-1734 kJ·mol-1
,由盖斯定律把两式相加,得2CH4(g)+4NO2(g)===2N2(g)+2CO2(g)+4H2O(g) ΔH=-1734 kJ·mol-1
转移电子数: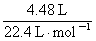 ×8=1.6 mol,故为1.6NA
×8=1.6 mol,故为1.6NA
放出热量:0.2 mol×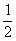 ×1 734 kJ·mol-1=173.4 kJ
×1 734 kJ·mol-1=173.4 kJ
(3)由于信息转化关系已确定,只要确定被分解物质的产物即可写出反应方程式。分解SO2由条件可推出SO2作氧化剂,只有还原为单质硫时才防止污染环境。


科目:高中化学 来源: 题型:
室温下,下列溶液中粒子浓度关系正确的是( )
A.Na2S溶液:c(Na+)>c(HS-)>c(OH-)>c(H2S)
B.Na2C2O4溶液:c(OH-)=c(H+)+c(HC2O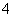 )+2c(H2C2O4)
)+2c(H2C2O4)
C.Na2CO3溶液:c(Na+)+c(H+)=2c(CO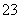 )+c(OH-)
)+c(OH-)
D.CH3COONa和CaCl2混合溶液:c(Na+)+c(Ca2+)=c(CH3COO-)+c(CH3COOH)+2c(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
某科研小组用MnO2和浓盐酸制备Cl2时,利用刚吸收过少量SO2的NaOH溶液对其尾气进行吸收处理。
(1)请完成SO2与过量NaOH溶液反应的化学方程式:SO2+2NaOH = ________________.
(2)反应Cl2+Na2SO3+2 NaOH===2NaCl+Na2SO4+H2O中的还原剂为________________.
(3)吸收尾气一段时间后,吸收液(强碱性)中肯定存在Cl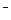 、OH
、OH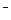 和SO
和SO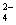 .请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气的CO2的影响).
.请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气的CO2的影响).
① 提出合理假设 .
假设1:只存在SO32-;假设2:既不存在SO32-也不存在ClO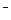 ;假设3:_____________.
;假设3:_____________.
② 设计实验方案,进行实验。请在答题卡上写出实验步骤以及预期现象和结论。限选实验试剂:3moL L-1H2SO4、1moL
L-1H2SO4、1moL L-1NaOH、0.01mol
L-1NaOH、0.01mol L-1KMnO4、淀粉-KI溶液、紫色石蕊试液.
L-1KMnO4、淀粉-KI溶液、紫色石蕊试液.
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量吸收液于试管中,滴加3 moL |
|
| 步骤2: | |
| 步骤3: |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列表示溶液中发生反应的化学方程式错误的是( )
A.2Al+2NaOH+2H2O====2NaAlO2+3H2↑
B.2KMnO4+HCOOK+KOH====2K2MnO4+CO2↑+H2O
C.MnO2+4HCl(浓)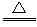 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
D.K2Cr2O7+6FeSO4+7H2SO4====Cr2(SO4)3+3Fe2(SO4)3+K2SO4+7H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
(NH4)2SO4在高温下分解,产物是SO2、H2O、N2和NH3。在该反应的化学方程式中,化学计量数由小到大的产物分子依次是
A.SO2、H2O、N2、NH3 B.N2、SO2、H2O、NH3
C.N2、SO2、NH3、H2O D.H2O、NH3、SO2、N2
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应中,氧化剂与还原剂物质的量的关系为1∶2的是
A.O3+2KI+H2O==2KOH+I2+O2
B.2CH3COOH+Ca(ClO)2==2HClO+Ca(CH3COO)2
C.I2+2NaClO3==2NaIO3+Cl2
D.4HCl+MnO2==MnCl2+Cl2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2;已知该反应中H2O2只发生如下过程:H2O2→ O2
(1)该反应中的还原剂是 。
(2)该反应中,发生还原反应的过程是 → 。
(3)写出该反应的化学方程式,并标出电子转移的方向和数目
。
(4)如反应转移了0.3mol电子,则产生的气体在标准状况下体积为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
萜品醇可作为消毒剂、抗氧化剂、医药和溶剂。合成α-萜品醇G的路线之一如下:

已知:RCOOC2H5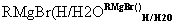
请回答下列问题:
(1)A所含官能团的名称是________。
(2)A催化氢化得Z(C7H12O3),写出Z在一定条件下聚合反应的化学方程式:__________________________________________。
(3)B的分子式为________;写出同时满足下列条件的B的链状同分异构体的结构简式:_____________________________________。
①核磁共振氢谱有2个吸收峰
②能发生银镜反应
(4)B→C、E→F的反应类型分别为________、________。
(5) C→D的化学方程式为________________________________。
(6)试剂Y的结构简式为________。
(7)通过常温下的反应,区别E、F和G的试剂是________和________。
(8)G与H2O催化加成得不含手性碳原子(连有4个不同原子或原子团的碳原子叫手性碳原子)的化合物H,写出H的结构简式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E均为有机化合物,它们之间的关系如图所示(提示:RCH=CHR′在酸性高锰酸钾溶液中反应生成RCOOH和R′COOH,其中R和R′为烷基)。
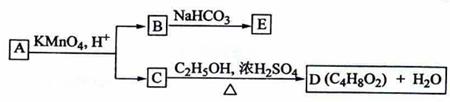
回答下列问题:
(1)直链化合物A的相对分子质量小于90,A分子中碳、氢元素的总质量分数为0.814,其余为氧元素,则A的分子式为 ;
(2)已知B与NaHCO3溶液完全反应,其物质的量之比为1:2,则在浓硫酸的催化下,B与足量的C2H5OH发生反应的化学方程式是 ,反应类型为
(3)A可以与金属钠作用放出氢气,能使溴的四氯化碳溶液褪色,则A的结构简式是
;
(4)D的同分异构体中,能与NaHCO3溶液反应放出CO2的有 种,其相应的结构简式是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com