
下列表示溶液中发生反应的化学方程式错误的是( )
A.2Al+2NaOH+2H2O====2NaAlO2+3H2↑
B.2KMnO4+HCOOK+KOH====2K2MnO4+CO2↑+H2O
C.MnO2+4HCl(浓)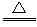 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
D.K2Cr2O7+6FeSO4+7H2SO4====Cr2(SO4)3+3Fe2(SO4)3+K2SO4+7H2O
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
次磷酸(H3PO2)是一种精细磷化工产品,具有较强还原性。回答下列问题:
(1)H3PO2是一种中强酸,写出其电离方程式:_____________________________
________________________________________________________________________。
(2)H3PO2及NaH2PO2均可将溶液中的Ag+还原为银,从而可用于化学镀银。
①H3PO2中,P元素的化合价为________。
②利用H3PO2进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4∶1,则氧化产物为________(填化学式)。
③NaH2PO2为________(填“正盐”或“酸式盐”),其溶液显________(填“弱酸性”“中性”或“弱碱性”)。
(3)H3PO2的工业制法是:将白磷(P4)与Ba(OH)2溶液反应生成PH3气体和Ba(H2PO2)2,后者再与H2SO4反应。写出白磷与Ba(OH)2溶液反应的化学方程式:____________________________________________。
(4)H3PO2也可用电渗析法制备,“四室电渗析法”工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过):
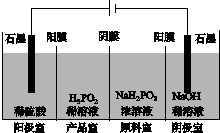
①写出阳极的电极反应式:_________________________________________。
②分析产品室可得到H3PO2的原因:_____________________________________
________________________________________________________________________。
③早期采用“三室电渗析法”制备H3PO2:将“四室电渗析法”中阳极室的稀硫酸用H3PO2稀溶液代替,并撤去阳极室与产品室之间的阳膜,从而合并了阳极室与产品室。其缺点是产品中混有________杂质,该杂质产生的原因是________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关物质的性质与应用不相对应的是( )
A.明矾能水解生成Al(OH)3胶体,可用作净水剂
B.FeCl3溶液能与Cu反应,可用于蚀刻印刷电路
C.SO2具有氧化性,可用于漂白纸浆
D.Zn具有还原性和导电性,可用作锌锰干电池的负极材料
查看答案和解析>>
科目:高中化学 来源: 题型:
正极材料为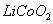
 的锂离子电池已被广泛用作便携式电源。但钴的资源匮乏限制了其进一步发展。
的锂离子电池已被广泛用作便携式电源。但钴的资源匮乏限制了其进一步发展。
(1) 橄榄石型
橄榄石型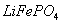 是一种潜在的锂离子电池正极材料,它可以通过
是一种潜在的锂离子电池正极材料,它可以通过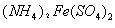 、
、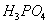 与
与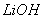 溶液发生共沉淀反应,所得沉淀经80℃真空干燥、高温成
溶液发生共沉淀反应,所得沉淀经80℃真空干燥、高温成 型而制得。
型而制得。
①共沉淀反应投料时,不将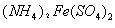 和
和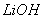 溶液直接混合的原因是 。
溶液直接混合的原因是 。
②共沉淀反应的化学方程式为 。
③高温成型前,常向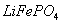 中加入少量活性炭黑,其作用除了可以改善成型后的
中加入少量活性炭黑,其作用除了可以改善成型后的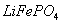 的导电性能外,还能 。
的导电性能外,还能 。
(2)废旧锂离子电池的正极材料试样(主要含有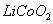 及少量AI、Fe等)可通过下列实验方法回收钴、锂。
及少量AI、Fe等)可通过下列实验方法回收钴、锂。
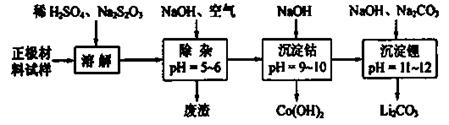
① 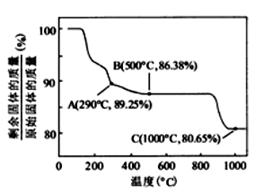 在上述溶解过程中,
在上述溶解过程中,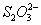 被氧化成
被氧化成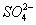 ,
,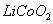 在溶解过程中反应的化学方程式为 。
在溶解过程中反应的化学方程式为 。
② 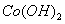 在空气中加热时,固体残留率随温度的变化如右图所示。已知钴的氢氧化物加热至290℃时已完全脱水,则1000℃时,剩余固体的成分为 。(填化学式);在350~400℃范围内,剩余固体的成分为 。(填化学式)。
在空气中加热时,固体残留率随温度的变化如右图所示。已知钴的氢氧化物加热至290℃时已完全脱水,则1000℃时,剩余固体的成分为 。(填化学式);在350~400℃范围内,剩余固体的成分为 。(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质中,按只有氧化性、只有还原性、既有氧化性又有还原性的顺序排列的一组是( )
A.F2、K、HCl B.Cl2、Al、H2
C.NO2、Na、Br2 D.O2、SO2、H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
二氧化硫和氮的氧化物是常用的化工原料,但也是大气的主要污染物。综合治理其污染是坏境化学当前的重要研究内容之一。
(1)硫酸生产中,SO2催化氧化生成SO3:
2SO2(s)+O2(g) 2SO3(g).
2SO3(g).
某温度下,SO2的平衡转化率(α)与体系总压强(P)的关系如下图所示。根据 图示回答下列问题:
图示回答下列问题:
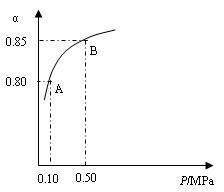
①将2.0 molSO2和1.0molO2置于10 L密闭容器中,反应达平衡后,体系总压强为0.10MPa。该反应的平衡常数等于__________。
②平衡状态由A变到B时,平衡常数K(A)_______K(B)(填“>”、“<”或“=”)。
(2)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ·mol-1
若用标准状况下4.48  L CH4还原NO2至N2,整个过程中转移的电子
L CH4还原NO2至N2,整个过程中转移的电子 总数为__________(阿伏加德罗常数的值用NA表示),放出的热量为___________kJ。
总数为__________(阿伏加德罗常数的值用NA表示),放出的热量为___________kJ。
(3)新型纳米材料氧缺位铁酸盐(MFe2Ox,3<x<4,M=Mn、Co、Zn或Ni)由铁酸盐(MFe2O4)经高温还原而得,常温下,它能使工业废气中的酸性氧化物分解除去。转化流程如图所示:
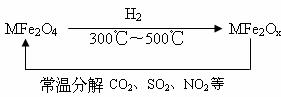
请写出MFe2Ox分解SO2的化学方程式________________(不必配平)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.按系统命名法,化合物
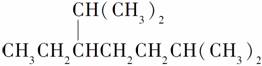 的名称为2,6-二甲基-5-乙基庚烷
的名称为2,6-二甲基-5-乙基庚烷
B.丙氨酸和苯丙氨酸脱水,最多可生成3种二肽
C.化合物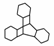 是苯的同系物
是苯的同系物
D.三硝酸甘油酯的分子式为C3H5N3O9
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com