
某校化学兴趣小组为探究铁与浓硫酸的反应,设计了图1、图2所示装置进行实验。 
(1)能说明有SO2气体产生的实验现象是 。
(2)图2中导气管e的主要作用为 。
(3)上述装置中图2中的NaOH溶液能吸收SO2尾气,防止污染,如将其更换为酸性KMnO4溶液,同样可以达到目的,试写出酸性KMnO4溶液与SO2反应的化学方程式:
。
(4)对比两套实验装置,不难发现图2装置除了能更好的吸收有毒气体SO2防止其污染环境外,还有一个非常明显的优点,你认为是 。
(5)反应一段时间后停止反应,待冷却后用胶头滴管吸取A试管中的溶液滴入到适量水中作为试样,试样中所含金属离子的成分有以下三种可能:
Ⅰ:只含有Fe3+;Ⅱ:只含有Fe2+; Ⅲ:既有Fe3+又有Fe2+。
为确认溶液的成分,选用如下试剂:
| A.稀HCl溶液 | B.稀硫酸 | C.KSCN溶液 | D.酸性KMnO4溶液 |
| 实验步骤 | 实验现象及结论 |
| 1、取一支洁净的试管,滴加1-2mL的试样溶液,再向试管中滴加几滴KSCN溶液 | (1) ,则说明Ⅱ成立。 (2) ,则说明溶液中存在Fe3+,则Ⅰ或Ⅲ成立。 |
| 2、 | 。 |
(1)B中品红溶液褪色 (1分)
(2)停止加热时,能防止倒吸或平衡压强(凡合理答案均可)(2分)
(3)2KMnO4+5SO2+2H2O=K2SO4+2MnSO4+2H2SO4(2分)
(4)便于控制反应的发生和停止 (2分)
(5)
实验步骤
实验现象及结论1、取一支洁净的试管,滴加1-2mL的试样溶液,再向试管中滴加几滴KSCN溶液 (1)如果没有观察到溶液颜色的明显变化,则说明Ⅱ成立。(1分)
(2)如果观察到溶液颜色转化为红色,则说明溶液中存在Fe3+,则Ⅰ或Ⅲ成立。(1分)2、 另取一支洁净的试管,加1-2mL试样溶液,用胶头滴管逐滴滴加酸性KMnO4溶液 。(1分) 如果滴加酸性KMnO4溶液后溶液的紫红色褪色,则说明溶液中含有Fe2+,说明Ⅲ成立;如果滴加酸性KMnO4溶液后溶液紫红色不褪,则说明溶液中没有Fe2+,说明Ⅰ成立。5Fe2+ + MnO4- +8H+ = 5Fe3+ + Mn2+ +4H2O 。(2分)
解析试题分析:(1)二氧化硫的特性是使品红溶液褪色,因此能说明有SO2气体产生的实验现象是:B中品红溶液褪色。
(2)停止加热时,装有铁和浓硫酸的试管中压强减小,有这样一根导管能防止倒吸或平衡压强。
(3)2KMnO4+5SO2+2H2O=K2SO4+2MnSO4+2H2SO4(2分)
(4)想让反应开始,把铁丝推一下让其接触浓硫酸,想让反应停止时,将铁丝拉离浓硫酸,这样便于控制反应的发生和停止
(5)铁离子与硫氰化钾反应可以生成血红色的溶液,用此来检验三价铁离子,二价铁离子的检验是得用其还原性。亚铁离子被高锰酸钾氧化,然后再利用硫氰化钾来进行确定。
考点:硫酸、二氧化硫及铁离子检验的有关知识。


科目:高中化学 来源: 题型:实验题
某化学小组用下列装置对铁及其化合物的性质进行探究,回答有关问题:
(1)该小组同学想制得氢氧化亚铁并保存较长时间,按如图(a)所示装置对其进行操作。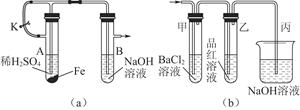
①某同学的操作是:先夹紧止水夹K,再使A管开始反应,实验中在B管中观察到的现象是
。
②为达到实验目的,正确的操作是 。
B管中发生反应的离子方程式是 。
(2)当上述装置的实验结束后,取A管内反应所得的溶液,隔绝空气小心蒸干后得到FeSO4,再高温煅烧(有关装置和操作均已略去),最后留下红棕色固体,将分解时产生的气体按图(b)所示装置依次通过洗气装置,结果试管甲内出现白色沉淀,试管乙内品红溶液红色褪去,回答:
①用方程式表示试管甲产生白色沉淀的原因
。
②为验证红棕色固体成分,可进行如下操作
。
③图(b)中丙装置的作用是 。
④根据实验现象写出A管内溶液蒸干后,在高温煅烧分解时所发生反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
现有NaHCO3和Na2CO3·xH2O的混合物,为了测定x值,某同学采用如图所示的装置进行实验(CaCl2、碱石灰均足量)。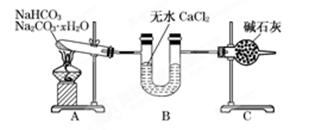
(1)A装置的作用:________________________________________________________________。
(2)B装置的作用是:_______________________________________________________________。
(3)C装置的作用是:_________________________________________________________________。
(4)若在装置A的试管中装入NaHCO3和Na2CO3·xH2O的混合物3.7 g,用酒精灯加热到反应完全,此时B管增重1.89g,C管增重0.22 g,则x的值为______。
(5)该装置还不是很完善,可能使测定结果偏小,应如何改进________。为什么?___________________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某研究小组利用下图装置探究SO2和Fe(NO3)3溶液的反应。已知:1.0 mol·L-1的Fe(NO3)3溶液的pH=1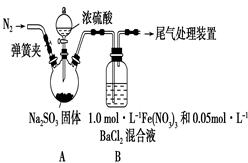
请回答:
(1)装置A中反应的化学方程式是______________________________;
(2)为排除空气对实验的干扰,滴加浓硫酸之前应进行的操作是_______________________________;
(3)装置B中产生了白色沉淀,其成分是________;
(4)分析B中产生白色沉淀的原因:
猜想1:SO2与Fe3+、酸性条件下NO3-都反应;
猜想2:SO2与Fe3+反应;
猜想3:在酸性条件下SO2与NO3-反应;
①按猜想2,装置B中反应的离子方程式是_________,证明该猜想正确应进一步确认生成了________;
②按猜想3,只需将装置B中的Fe(NO3)3溶液替换为等体积的下列溶液,在相同条件下进行实验。应选择的试剂是________(填字母)。
a.0.1 mol·L-1稀硝酸
b.1.5 mol·L-1Fe(NO3)2溶液
c.6.0 mol·L-1 NaNO3和0.2 mol·L-1盐酸等体积混合的溶液
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
FeCl3在现代工业生产中应用广泛。某化学研究性学习小组模拟工业流程制备无水FeCl3,再用副产品FeCl3溶液吸收有毒的H2S。
I、经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华。他们设计了制备无水 FeCl3的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下: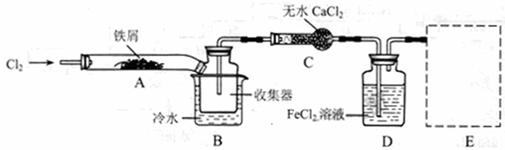
①检验装置的气密性;
②通入干燥的Cl2,赶尽装置中的空气;
③用酒精灯在铁屑下方加热至反应完成;
④……
⑤体系冷却后,停止通入Cl2,并用干燥的H2赶尽Cl2,将收集器密封。
请回答下列问题:
(1)装置A中反应的化学方程式为 。
(2)第③步加热后,生成的烟状FeCl3大部分进入收集器,少量沉积在反应管A右端。要使沉积的FeCl3进入收集器,第④步操作是 。
(3)操作步骤中,为防止FeCl3潮解所采取的措施有(填步骤序号) 。
(4)如果没有装置C的设计,会导致 。
(5)用离子方程式表示虚线框E中所增加装置和试剂的作用: 。
(6)用装置D中的副产品FeCl3溶液吸收H2S,得到单质硫,
请写出反应的离子方程式: 。
Ⅱ、反应结束后,将收集器中所得固体完全溶于稀盐酸,小组同学对所得溶液金属阳离子的成分有三种观点:①只有Fe3+;②只有Fe2+;③ 。
为探究溶液的组成,实验如下:
| 实验步骤 | 实验现象 | 实验结论及反应离子方程式 |
| ①取少量所得溶液于试管中,加入少量KSCN溶液。 | | 说明:假设②不成立,假设①或③成立;的离子方程式是 。 |
| ②另取少量所得溶液于试管中,加入少量酸性 KMnO4溶液。 | 溶液紫红色退去 | 说明: 。 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某同学欲在实验室中完成Fe与水蒸气反应的实验,装置如图甲、乙两种。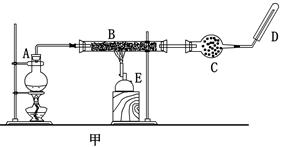
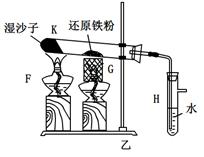
已知:B中放入的是铁与石棉绒的混合物,C中放的是干燥剂,E为酒精喷灯,G为带有铁丝网罩的酒
精灯。对比两装置,回答下列问题:
(1)如何检查乙装置的气密性: 。
(2)乙装置中湿沙子的作用是: 。
(3)B处发生反应的化学方程式: 。
(4)称取mg铁粉与适量石棉绒混合,然后加热至无气体放出。若收集的气体体积换算为标准状况为VL,铁粉的转化率为 (列出计算式即可,不必化简)。
(5)为了证明反应后的固体混合物中含有+3价的Fe,该同学取出少量混合物于试管中,加入一定量的盐酸使固体混合物溶解,过滤,立即向滤液中滴加KSCN溶液,结果观察到溶液的颜色没变化。经过思考,该同学认为此现象不能说明反应后的固体混合物中不含有+3价Fe。他的理由是: _。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
亚铁盐在空气中一般都易被氧化,而摩尔盐[(NH4)2SO4·FeSO4·6H2O]比一般的亚铁盐要稳定,但受热时易分解易被氧化。其实验室的制备原理为:FeSO4+(NH4)2SO4+6H2O=(NH4)2SO4·FeSO4·6H2O↓
如图为制取摩尔盐的简要流程: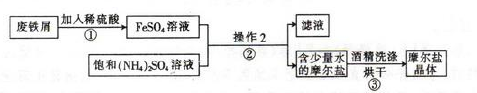
请回答下列问题:
(1)步骤①中反应容器应尽量避免摇晃或搅拌,目的是 。
(2)步骤②中的操作是加热蒸发、 、 。为什么不能加热蒸干? 。
(3)摩尔盐中NH4+、Fe2+、SO42-的检验:
①甲同学提出可以用湿润的 试纸、稀盐酸和 溶液来检验这三种离子。
②乙同学提出检验其中的Fe2+,可以用KSCN溶液和 ,预期的现象和结论是 。
③实际操作中,乙同学加人KSCN溶液时,发现溶液变成浅红色,于是他对自己的方法提出了怀疑。丙同学经过仔细思考认为,乙同学的方法是可行的,这是因为 。
(4)丁同学欲测定摩尔盐中Fe2+的含量。他称取了4. 0g摩尔盐样品,溶于水,并加入适量稀硫酸,用0.20mol/L的KMnO4溶液滴定,消耗KMnO4溶液10.00mL
①本实验的指示剂是 (填字母)。
| A.酚酞 | B.石蕊 | C.甲基橙 | D.不需要 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
已知Fe(NO3)2受热分解产物为金属氧化物、NO2和O2,请完成表格内容并回答相关问题:
(1)对固体产物中Fe化合价的猜想:
猜想一:只显+2价 猜想二:只显+3价;猜想三: 。
(2)为证明猜想二通过完成下表加以验证。供选试剂有: 0.01 mol/L 酸性KMnO4溶液、0.1 mol/L H2SO4溶液、3%H2O2溶液、0.1 mol/LKSCN溶液、蒸馏水。(仪器自添)
| 实验操作 | 现象 | 目的或结论 |
| 步骤1:取适量上述热分解后的固体于试管中,加入0.1 mol/L H2SO4溶液使其充分溶解,将上层清液分加到A、B两支试管中 | | 溶解固体产物 |
| 步骤2: | | 溶液中含有Fe3+ |
| 步骤3: | | 溶液中不含 Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
把100mL 2mol/L的H2SO4跟过量锌粉反应,在一定温度下,为了减缓反应速率而不影响生成H2的总量,可在反应物中加入适量的
| A.硫酸铜溶液 | B.硝酸钠溶液 | C.醋酸钠溶液 | D.氢氧化钠溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com