
【题目】以乙烯为原料,可以制备乙酸乙酯
![]()
(1) ③的反应类型是_________,乙醇分子中官能团的名称是 _______________ 。
(2) 写出反应①的化学方程式____________________________________________。
(3)利用图示装置制取乙酸乙酯。写出生成乙酸乙酯的化学方程式:__________________________。
(4)如图实验操作中,将产物通入饱和碳酸钠溶液中,导管不能插入到碳酸钠溶液中是为了防止:_______,饱和碳酸钠溶液的作用是:_________________________________________。
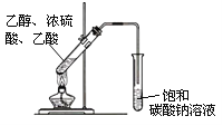
【答案】取代反应 羟基 CH2=CH2+H2O→CH3CH2OH CH3COOH+CH3CH2OH ![]() CH3COOCH2CH3+H2O 倒吸 溶解乙醇,中和乙酸,便于乙酸乙酯析出
CH3COOCH2CH3+H2O 倒吸 溶解乙醇,中和乙酸,便于乙酸乙酯析出
【解析】
乙烯(CH2=CH2)与H2O发生加成反应生成乙醇(C2H5OH),乙醇经过氧化反应可生成乙酸(CH3COOH),乙酸与乙醇发生酯化反应生成乙酸乙酯。
(1)根据分析,③是乙醇和乙酸的酯化反应,酯化反应属于取代反应;乙醇(C2H5OH)中的官能团是羟基;
(2)根据分析,反应①是乙烯与水的加成反应,方程式为:CH2=CH2+H2O→CH3CH2OH;
(3)用乙醇和乙酸在浓硫酸的催化下制备乙酸乙酯,方程式为:CH3COOH+CH3CH2OH ![]() CH3COOCH2CH3+H2O;
CH3COOCH2CH3+H2O;
(4)由于蒸出去的乙醇可以溶于饱和碳酸钠溶液,乙酸可以与饱和碳酸钠溶液反应,如果导管插入液面下,会发生倒吸的现象,所以导管不能插入到碳酸钠溶液中是为了防止倒吸;饱和碳酸钠溶液可以吸收蒸出的乙醇,与蒸出的乙酸反应,并且能够降低乙酸乙酯的溶解度,便于乙酸乙酯析出;


科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)是一种高效的漂白剂和氧化剂,可用于各种纤维和某些食品的漂白。马蒂逊(Mathieson)法制备亚氯酸钠的流程如下:
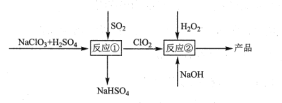
下列说法错误的是( )
A. 反应①阶段,参加反应的NaClO3和SO2的物质的量之比为2:1
B. 若反应①通过原电池来实现,则ClO2是正极产物
C. 反应②中的H2O2可用NaClO2代替
D. 反应②条件下,ClO2的氧化性大于H2O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】头孢拉定又名先锋霉素,是常用的一种抗生素,其结构简式如图:
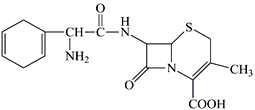
下列说法不正确的是( )
A. 头孢拉定的分子式是C16H19N3O4S,分子中有多种官能团
B. 头孢拉定与Na2CO3溶液、NaHCO3溶液都可以反应
C. 1mol头孢拉定最多可与6molH2和5mol Br2发生加成反应
D. 头孢拉定既可与盐酸反应,也可与NaOH溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
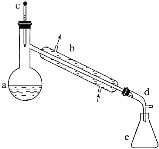
【题目】醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下:
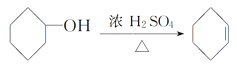 +H2O
+H2O
可能用到的有关数据如下:
相对分子质量 | 密度/ g·cm-3 | 沸点/℃ | 溶解性 | |
环己醇 | 100 | 0.9618 | 161 | 微溶于水 |
环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
合成反应:
在a中加入20g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1mL浓硫酸。b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃。
分离提纯:
反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙。最终通过蒸馏得到纯净环己烯10g。
回答下列问题:
(1)装置b的名称是______。
(2)加入碎瓷片的作用是________;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是________(填字母,下同)。
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(3)本实验中最容易产生的副产物的结构简式为________________。
(4)分液漏斗在使用前须清洗干净并______;在本实验分离过程中,产物应该从分液漏斗的_______(填“上口倒出”或“下口放出”)。
(5)分离提纯过程中加入无水氯化钙的目的是______________。
(6)在环己烯粗产物蒸馏过程中,不可能用到的仪器有________。
A 圆底烧瓶 B 温度计 C 吸滤瓶 D 球形冷凝管 E 接收器
(7)本实验所得到的环己烯产率是________。
A.41% B.50% C.61% D.70%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯乙烯(![]() )是生产各种塑料的重要单体,可通过乙苯催化脱氢制得:
)是生产各种塑料的重要单体,可通过乙苯催化脱氢制得:
![]() (g)
(g)![]()
![]() (g)+H2(g)△H
(g)+H2(g)△H
(1)已知:
化学键 | C-H | C-C | C=C | H-H |
键能/kJ/mol | 412 | 348 | 612 | 436 |
计算上述反应的△H=________kJ·mol-1。
(2)500℃时,在恒容密闭容器中,充入amol乙苯,反应达到平衡后容器内气体的压强为P;若再充入bmol的乙苯,重新达到平衡后容器内气体的压强为2P,则a_______b(填“>”“<”或“=”),乙苯的转化率将________(填“增大”“减小”或“不变”)。
(3)工业上,通常在乙苯(EB)蒸气中掺混N2(原料气中乙苯和N2的物质的量之比为1︰10,N2不参与反应),控制反应温度600℃,并保持体系总压为0.1Mpa不变的条件下进行反应。在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了H2以外的产物中苯乙烯的物质的量分数)示意图
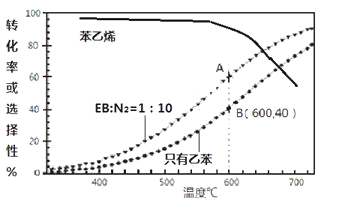
①A、B两点对应的正反应速率较大的是________。
②掺入N2能提高乙苯的平衡转化率,解释说明该事实____________。
③控制反应温度为600℃的理由是__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为光电催化能源化利用CO2制备太阳能燃料的示意图。下列说法不正确的是
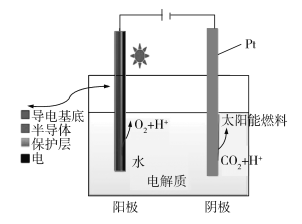
A.阳极反应式为2H2O4e![]() 4H++O2↑
4H++O2↑
B.CO2还原产物可能为CO、HCHO、CH3OH、CH4等
C.阳极、阴极材料互换对制备太阳能燃料影响不大
D.若太阳能燃料为甲醇,则阴极电极反应式为:CO2+6H++6e![]() CH3OH+H2O
CH3OH+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为室温时不同pH下磷酸盐溶液中含磷微粒形态的分布,其中a、b、c三点对应的pH分别为2.12、7.21、11.31,其中δ表示含磷微粒的物质的量分数,下列说法正确的是
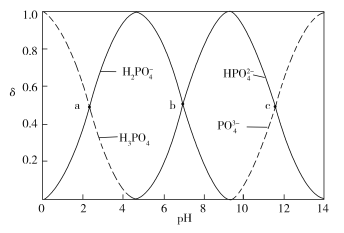
A.2 mol H3PO4与3 mol NaOH反应后的溶液呈中性
B.NaOH溶液滴定Na2HPO4溶液时,无法用酚酞指示终点
C.H3PO4的二级电离常数的数量级为107
D.溶液中除OH离子外,其他阴离子浓度相等时,溶液可能显酸性、中性或碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增大,W与Y最外层电子数之和为X的最外层电子数的2倍,Z最外层电子数等于最内层电了数,X、Y、Z的简单离子的电子层结构相同,W的单质是空气中体积分数最大的气体。下列说法正确的是
A. Y的最高价氧化物对成水化物的酸性比W的强
B. W的气态氢化物比X的稳定
C. 离子半径的大小顺序:r(w)>r(X)>r(Y)>(Z)
D. XY2与ZY2中的化学键类型相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述的化学反应状态,不一定是平衡状态的是( )
A.H2(g)+Br2(g) ![]() 2HBr(g),恒温、恒容下,反应体系中气体的颜色保持不变
2HBr(g),恒温、恒容下,反应体系中气体的颜色保持不变
B.2NO2(g) ![]() N2O4(g),恒温、恒容下,反应体系中气体的压强保持不变
N2O4(g),恒温、恒容下,反应体系中气体的压强保持不变
C.CaCO3(s)![]() CO2(g)+ CaO(s),恒温、恒容下,反应体系中气体的密度保持不变
CO2(g)+ CaO(s),恒温、恒容下,反应体系中气体的密度保持不变
D.N2(g)+3H2(g) ![]() 2NH3(g),反应体系中H2与N2的物质的量之比保持3:1
2NH3(g),反应体系中H2与N2的物质的量之比保持3:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com