
【题目】下列说法不正确的是( )
A. 氯气能使湿润的有色布条褪色,所以氯气具有漂白性
B. 红热的铁丝在氯气中剧烈燃烧,反应生成氯化铁
C. 利用溴单质的氧化性可以把碘离子转化为碘单质
D. 实验室常用氢氧化钠溶液吸收多余的氯气以避免污染
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:
【题目】甲、乙、丙三种物质均含有同一种中学常见元素X,其转化关系如下,下列说法不正确的是
![]()
A.若A为硝酸,X为金属元素,则甲与丙反应可生成乙
B.若乙为NaHCO3,则丙一定是CO2
C.若A为NaOH溶液,X为短周期的金属元素,则乙一定为白色沉淀
D.若A为金属单质,乙的水溶液遇KSCN溶液变红,则甲可能为非金属单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列选项中,均为微量元素的是
A. C、H、0、N、P、S B. K、Ca、Mg、Mn、Zn
C. Mn、Zn、Cu、B、Mo D. Fe、Mn、B、Zn、Ca
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:(1)H2(g) +1/2O2(g)=H2O(g) △H=-241.8 kJ/mol
(2)1/2N2 (g) + O2(g)=NO2(g) △H=+33.9 kJ/mol
(3)1/2N2 (g) +3/2 H2(g)=NH3(g) △H=-46.0 kJ/mol
计算NH3(g)燃烧生成NO2(g)和H2O(g)的燃烧热
A.282.8 kJ/mol B.-282.8 kJ/mol C.848.4kJ/mol D.-848.4 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有H+、NH4+、Fe3+、CO32-、SO42-、NO3-中的几种。
①若加入锌粒,产生无色无味的气体,且在空气中不变色;
②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加人NaO的物质的量之间的关系如下图所示。则下列说法正确的是

A.溶液中的阳离子只有H+、Mg2+、Al3 +
B.溶液中一定不含CO32-,可能含有SO42-和NO3-
C.溶液中n(NH4+)=0.2mol
D.n(H+):n(Al3+):n(Mg2+)=1:1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:
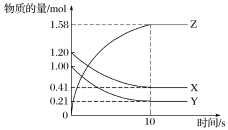
(1)从反应开始到10 s时,用Y表示的反应速率为____________________。
(2)该反应的化学方程式为_______________________。
(3)若上述反应分别在甲、乙、丙三个相同的密闭容器中进行,经同一段时间后,测得三个容器中的反应速率分别为:
甲:v(X)=0.3 mol·L-1·s-1;
乙:v(Y)=0.12 mol·L-1·s-1
丙:v(Z)=9.6 mol·L-1·min-1;
则甲、乙、丙三个容器中反应速率由慢到快的顺序为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在Cl-的物质的量浓度为0.5molL-1的某无色澄清溶液中,还可能含有如表中所示的若干种离子.
阳离子 | K+ Al3+ Mg2+ Ba2+ Fe3 |
阴离子 | NO3- CO32- SiO32- SO42- OH- |
现取该溶液200mL进行如下实验(气体体积均在标准状况下测定).
序号 | 实验内容 | 实验结果 |
Ⅰ | 向该溶液中加入足量稀盐酸 | 产生白色沉淀并放出标准状况下0.56L气体 |
Ⅱ | 将Ⅰ的反应混合液过滤,对沉淀洗涤、灼烧至恒重,称量所得固体质量 | 固体质量为2.4g |
Ⅲ | 向Ⅱ的滤液中滴加BaCl2溶液 | 无明显现象 |
请回答下列问题.
(1)通过以上实验不能确定是否存在的离子是
(2)实验Ⅰ中生成气体的离子方程式为
(3)通过实验Ⅰ、Ⅱ、Ⅲ和必要计算,请写出一定存在的阴离子及其浓度(不一定要填满).
阴离子 | 浓度c/(mol/L) |
(4)判断K+是否存在,若存在,求出其最小浓度,若不存在说明理由: _
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某一容积为5 L的密闭容器内,加入 0.2 mol的CO和0.2 mol的H2O,在催化剂存在和800℃的条件下加热,发生如下反应:CO(g)+H2O(g)![]() CO2(g)+H2(g);ΔH>0反应中CO2的浓度随时间变化情况如下图:
CO2(g)+H2(g);ΔH>0反应中CO2的浓度随时间变化情况如下图:
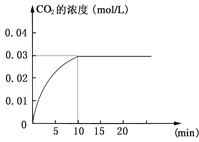
(1)根据上图数据,反应开始至达到平衡时,CO的化学反应速率为v(CO)= mol/(L·min);反应达平衡时,c(H2)=____________mol/L,该温度下的平衡常数K= (计算出结果)。
(2)判断该反应达到平衡的依据是________________。
① CO减少的化学反应速率和CO2减少的化学反应速率相等
② CO、H2O、CO2、H2的浓度都相等
③ CO、H2O、CO2、H2的浓度都不再发生变化
④ 正、逆反应速率都为零
(3)如要一开始加入0.1 mol的CO、0.1 mol的H2O、0.1 mol的 CO2和0.1 mol的H2,在相同的条件下,反应达平衡时,c(H2O)=_____________mol/L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com