
【题目】在Cl-的物质的量浓度为0.5molL-1的某无色澄清溶液中,还可能含有如表中所示的若干种离子.
阳离子 | K+ Al3+ Mg2+ Ba2+ Fe3 |
阴离子 | NO3- CO32- SiO32- SO42- OH- |
现取该溶液200mL进行如下实验(气体体积均在标准状况下测定).
序号 | 实验内容 | 实验结果 |
Ⅰ | 向该溶液中加入足量稀盐酸 | 产生白色沉淀并放出标准状况下0.56L气体 |
Ⅱ | 将Ⅰ的反应混合液过滤,对沉淀洗涤、灼烧至恒重,称量所得固体质量 | 固体质量为2.4g |
Ⅲ | 向Ⅱ的滤液中滴加BaCl2溶液 | 无明显现象 |
请回答下列问题.
(1)通过以上实验不能确定是否存在的离子是
(2)实验Ⅰ中生成气体的离子方程式为
(3)通过实验Ⅰ、Ⅱ、Ⅲ和必要计算,请写出一定存在的阴离子及其浓度(不一定要填满).
阴离子 | 浓度c/(mol/L) |
(4)判断K+是否存在,若存在,求出其最小浓度,若不存在说明理由: _
【答案】(1)NO3- OH-(2)CO32-+2H+=CO2↑+H2O
(3)
阴离子 | 浓度c/(mol/L) |
CO32- | 0.125 |
SiO32- | 0.2 |
(4)存在,由电荷守恒可知K+最小浓度为1.15 molL-1
【解析】
试题分析:由题意知溶液为澄清溶液,因此溶液中含有的离子必须能大量共存.由实验Ⅰ可知,该溶液中一定含有CO32-,实验Ⅰ中生成气体的离子方程式为CO32-+2H+=CO2↑+H2O,其浓度为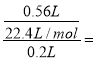 =0.125mol/L,则一定没有Ag+、Mg2+、Ba2+;由生成白色沉淀判断溶液中一定含有SiO32-,发生反应SiO32-+2H+=H2SiO3↓,SiO32-的浓度为
=0.125mol/L,则一定没有Ag+、Mg2+、Ba2+;由生成白色沉淀判断溶液中一定含有SiO32-,发生反应SiO32-+2H+=H2SiO3↓,SiO32-的浓度为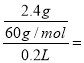 =0.2mol/L.由实验Ⅲ可知溶液中不含SO42-,根据电荷守恒2c(CO32-)+2c(SiO32-)+c(Cl-)=2×0.125mol/L+2×0.2mol/L+0.5 mol/L =1.15mol/L,因此溶液中一定含有K+,且其浓度至少为1.15mol/L,不能确定NO3-、OH-是否存在。
=0.2mol/L.由实验Ⅲ可知溶液中不含SO42-,根据电荷守恒2c(CO32-)+2c(SiO32-)+c(Cl-)=2×0.125mol/L+2×0.2mol/L+0.5 mol/L =1.15mol/L,因此溶液中一定含有K+,且其浓度至少为1.15mol/L,不能确定NO3-、OH-是否存在。


科目:高中化学 来源: 题型:
【题目】X和Y属短周期元素,Y原子的最外层电子数是次外层电子数的3倍,X位于Y的后一周期,且最外层电子数是次外层电子数的一半,则X和Y形成的化合物的化学式可表示为( )
A. XY B. XY2 C. XY3 D. X2Y3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. 氯气能使湿润的有色布条褪色,所以氯气具有漂白性
B. 红热的铁丝在氯气中剧烈燃烧,反应生成氯化铁
C. 利用溴单质的氧化性可以把碘离子转化为碘单质
D. 实验室常用氢氧化钠溶液吸收多余的氯气以避免污染
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置进行以下实验,能得到相应实验结论的是( )
选项 | ① | ② | ③ | 实验结论 |
|
A | 稀硫酸 | 石灰石 | 澄清石灰水 | 制二氧化碳并吸收尾气 | |
B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 | |
C | 稀盐酸 | Na2SO3 | H2S溶液 | SO2具有还原性 | |
D | 浓硝酸 | Na2CO3 | Na2SiO3 | 溶液酸性:硝酸>碳酸>硅酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学变化一定存在:①状态和颜色的变化 ②发光放热 ③生成新物质 ④气体的放出 ⑤能量的变化( )
A. ③ B. ③⑤ C. ②④⑤ D. ①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知酸性K2Cr2O7溶液可与FeSO4反应生成Fe3+和Cr3+。现将硫酸酸化的K2Cr2O7溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如图所示,下列说法中不正确的是( )
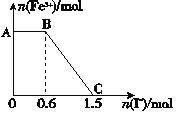
A.图中AB段的氧化剂为K2Cr2O7
B.图中BC段发生的反应为2Fe3++2I-=2Fe2++I2
C.开始加入的K2Cr2O7为0.15 mol
D.K2Cr2O7与FeSO4反应的物质的量之比为1∶6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将250mL含BaCl2和KCl的混合溶液分成5等份,取一份加入含amol硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含bmol硝酸银的溶液,恰好使氯离子完全沉淀。则原混合溶液中钾离子物质的量浓度为
A.4(b-2a)mol/L
B.20(2a-b)mol/L
C.20(b-2a)mol/L
D.10(b-a)mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于铅蓄电池Pb+PbO2+2H2SO4![]() PbSO4+2H2O的说法正确的是
PbSO4+2H2O的说法正确的是
A.在放电时,正极发生的反应是Pb(s)+SO42—(aq)=PbSO4(s)+2e—
B.在放电时,该电池的负极材料是铅板
C.在充电时,电池中硫酸的浓度不断变小
D.在充电时,阳极发生的反应是PbSO4(s)+2e-=Pb(s)+SO42-(aq)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com