
【题目】常温下,向50mL溶有0.1molCl2的氯水中滴加2mol/L的NaOH溶液,得到溶液pH随所加NaOH溶液体积的变化图像如下。下列说法正确的是( )

A.若a点pH=4,且c(Cl-)=m c(ClO-),则Ka(HClO)=![]()
B.若x=100,b点对应溶液中:c(OH-)>c(H+),可用pH试纸测定其pH
C.若y=200,c点对应溶液中:c(OH-)—c(H+)=2c(Cl-)+c(HClO)
D.b~c段,随NaOH溶液的滴入,![]() 逐渐增大
逐渐增大
【答案】C
【解析】
试题分析:A、发生Cl2+H2O=HCl+HClO,c(Cl-)=c(H+)=10-4mol·L-1,根据c(Cl-)=m c(ClO-),可以推出c(ClO-)=10-4/mmol·L-1,溶液中HClO的浓度:c(HClO)=(10-4-10-4/m)mol·L-1,根据Ka=c(ClO-)×c(H+)/c(HClO)=10-4/(m-1),故错误;B、Cl2+2NaOH=NaCl+NaClO+H2O,x=100,两者恰好完全反应,溶质为NaCl和NaClO,溶液显碱性,不能用pH测定pH,因为NaClO具有强氧化性,能把有色物质漂白,不能读出数值,故错误;C、y=200,氢氧化钠过量,反应后溶质为NaOH、NaCl、NaClO,且三者物质的量相等,电荷守恒:c(Na+)+c(H+)=c(Cl-)+c(OH-)+c(ClO-),物料守恒:2c(Cl-)+2c(ClO-)+2c(HClO)=c(Na+),两式合并,得出c(OH-)=c(Cl-)+c(ClO-)+2c(HClO)+c(H+),而c(ClO-)+c(HClO)=c(Cl-),因此有c(OH-)-c(H+)=2c(Cl-)+c(HClO),故正确;D、随着氢氧化钠量的增加,c(HClO)减少,c(ClO-)增加,因此比值减小,故错误。


科目:高中化学 来源: 题型:
【题目】下列涉及有机物的性质或应用的说法不正确的是
A. 淀粉、纤维素、蛋白质都是天然高分子化合物
B. 酶是一类特殊的蛋白质,是生物体内重要的催化剂
C. 从牛奶中提取的酪素,可以用来制作食品和塑料
D. 纤维素、蔗糖、葡萄糖和脂肪在一定条件下都可发生水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在甲、乙、丙三个不同密闭容器中按不同方式投料,一定条件下发生反应(起始温度和起始体积相同):A2(g)+3B2(g)![]() 2AB3(g)ΔH<0,相关数据如下表所示:ΔH<0,相关数据如下表所示:
2AB3(g)ΔH<0,相关数据如下表所示:ΔH<0,相关数据如下表所示:
容器 | 甲 | 乙 | 丙 |
相关条件 | 恒温恒容 | 绝热恒容 | 恒温恒压 |
反应物投料 | 1mol A2、3mol B2 | 2mol AB3 | 2mol AB3 |
平衡时容器体积 | V甲 | V乙 | V丙 |
反应的平衡常数K= | K甲 | K乙 | K丙 |
平衡时AB3的浓度/mol·L-1 | c甲 | c乙 | c丙 |
平衡时AB3的反应速率/mol·L-1·min-1 | v甲 | v乙 | v丙 |
下列说法正确的是 ( ) ( )
A.v甲=v丙 B.c乙>c甲 C.V甲>V丙 D.K乙<K丙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2.32g Na2CO3、NaOH的固体混合物完全溶解于水,制成溶液,然后向该溶液中逐滴加入1mol / L的盐酸,所加盐酸的体积与产生CO2的体积(标准状况)关系如下图所示,下列说法中错误的是 ( )

A.OA段发生反应的离子方程式为: H++OH-= H2O、CO32-+H+=HCO3-
B.当加入35 mL盐酸时,产生CO2的体积为224 mL
C .A点溶液中的溶质为NaCl、Na HCO3
D.混合物中NaOH的质量0.60g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
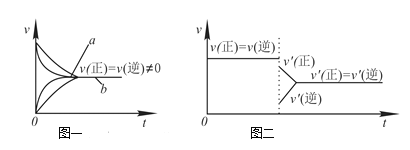
A.Na2S2O3+2HCl==2NaCl+S↓+SO2↑+H2O在加热条件下化学反应速率增大的主要原因是该反应是吸热反应,加热使平衡向正反应方向移动
B.若在恒容容器中发生反应:N2+3H2![]() 2NH3,达到平衡后再充入适量He,由于压强增大,化学平衡向正反应方向移动
2NH3,达到平衡后再充入适量He,由于压强增大,化学平衡向正反应方向移动
C.在合成氨反应中,其他条件相同时,在有催化剂时(a)和无催化剂时(b)的速率—时间图像可用图一表示
D.若在恒压容器中发生反应:2SO3![]() 2SO2+O2,达到平衡后再充入适量He,其速率—时间图像可用图二表示
2SO2+O2,达到平衡后再充入适量He,其速率—时间图像可用图二表示
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应aM(g)+bN(g)![]() cP(g)+d Q(g)达到平衡时,M的体积分数y(M)与反应条件的关系如图所示。其中z 表示反应开始时N的物质的量与M的物质的量之比。下列说法不正确的是( )
cP(g)+d Q(g)达到平衡时,M的体积分数y(M)与反应条件的关系如图所示。其中z 表示反应开始时N的物质的量与M的物质的量之比。下列说法不正确的是( )
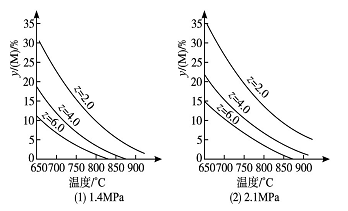
A.同温同压同z时,加入催化剂,平衡时Q的体积分数不改变
B.同温同压时,增加z,平衡时Q的体积分数一定增加
C.同温同z时,增加压强,平衡时Q的体积分数一定减小
D.同压同z时,升高温度,平衡时Q的体积分数一定增加
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图装置测定中和热的实验步骤如下:
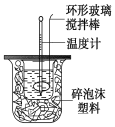
①用量筒量取50 mL 0.25 mol/L硫酸倒入小烧杯中,测出硫酸温度;
②用另一量筒量取50 mL 0.55 mol/L NaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度。
回答下列问题:
(1)写出稀硫酸和稀氢氧化钠溶液反应,表示中和热的热化学方程式(中和热数值为57.3 kJ/mol) 。
(2)倒入NaOH溶液的正确操作是 (从下列选出)。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(3)使硫酸与NaOH溶液混合均匀的正确操作是 (从下列选出)。
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃棒搅拌棒轻轻地搅动
(4)实验数据如下表:
①请填写下表中的温度差平均值:
温度 实验次数 | 起始温度 t1/℃ | 终止温度t2/℃ | 温度差平均值(t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 29.5 | |
2 | 25.9 | 25.9 | 25.9 | 29.2 | |
3 | 26.4 | 26.2 | 26.3 | 29.8 | |
②近似认为0.55 mol/L NaOH溶液和0.25 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃),则中和热ΔH= (取小数点后一位)。
③上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是(填字母) 。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时平视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后,用另一支温度计测定H2SO4溶液的温度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com