
����Ŀ��������ͼװ�òⶨ�к��ȵ�ʵ�鲽�����£�
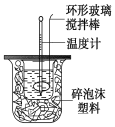
������Ͳ��ȡ50 mL 0.25 mol/L���ᵹ��С�ձ��У���������¶ȣ�
������һ��Ͳ��ȡ50 mL 0.55 mol/L NaOH��Һ��������һ�¶ȼƲ�����¶ȣ�
����NaOH��Һ����С�ձ��У��跨ʹ֮��Ͼ��ȣ�������Һ����¶ȡ�
�ش��������⣺
(1)д��ϡ�����ϡ����������Һ��Ӧ����ʾ�к������Ȼ�ѧ����ʽ(�к�����ֵΪ57.3 kJ/mol) ��
(2)����NaOH��Һ����ȷ������ (������ѡ��)��
A���ز������������� B���������������� C��һ��Ѹ�ٵ���
(3)ʹ������NaOH��Һ��Ͼ��ȵ���ȷ������ (������ѡ��)��
A�����¶ȼ�С�Ľ��� B���ҿ�ӲֽƬ�ò���������
C����������ձ� D���������¶ȼ��ϵĻ��β��������������ؽ���
(4)ʵ���������±���
������д�±��е��¶Ȳ�ƽ��ֵ��
�¶� ʵ����� | ��ʼ�¶� t1/�� | ��ֹ�¶�t2/�� | �¶Ȳ�ƽ��ֵ(t2��t1)/�� | ||
H2SO4 | NaOH | ƽ��ֵ | |||
1 | 26.2 | 26.0 | 26.1 | 29.5 | |
2 | 25.9 | 25.9 | 25.9 | 29.2 | |
3 | 26.4 | 26.2 | 26.3 | 29.8 | |
��������Ϊ0.55 mol/L NaOH��Һ��0.25 mol/L������Һ���ܶȶ���1 g/cm3���кͺ�������Һ�ı�����c��4.18 J/(g����)�����к�����H�� (ȡС�����һλ)��
������ʵ����ֵ�����57.3 kJ/mol��ƫ�����ƫ���ԭ�������(����ĸ) ��
a��ʵ��װ�ñ��¡�����Ч����
b����ȡNaOH��Һ�����ʱƽ�Ӷ���
c���ֶ�ΰ�NaOH��Һ����ʢ�������С�ձ���
d�����¶ȼƲⶨNaOH��Һ��ʼ�¶Ⱥ�����һ֧�¶ȼƲⶨH2SO4��Һ���¶�
���𰸡�
(1)![]() H2SO4(aq)+NaOH(aq)=
H2SO4(aq)+NaOH(aq)=![]() Na2SO4(aq)+H2O(l)��H=-57.3 kJ/mol��
Na2SO4(aq)+H2O(l)��H=-57.3 kJ/mol��
(2)C��(3)D��(4)��3.4����-56.8kJ/mol����ac��
��������
���������(1)�к�����ָ��ϡ��Һ�У�ǿ���ǿ����кͷ�Ӧ����1mol H2Oʱ���ų�57.3kJ�����������ʾ1�к��ȵ��Ȼ�ѧ����ʽΪ��![]() H2SO4(aq)+NaOH(aq)=
H2SO4(aq)+NaOH(aq)=![]() Na2SO4(aq)+H2O(l)��H=-57.3 kJ/mol���ʴ�Ϊ��
Na2SO4(aq)+H2O(l)��H=-57.3 kJ/mol���ʴ�Ϊ��![]() H2SO4(aq)+NaOH(aq)=
H2SO4(aq)+NaOH(aq)=![]() Na2SO4(aq)+H2O(l)��H=-57.3 kJ/mol��
Na2SO4(aq)+H2O(l)��H=-57.3 kJ/mol��
(2)����������������Ʒ�Ӧ��ӦѸ�پ��ң������ͷŴ����ȣ�һ���Կ��ٵ�����Լ�������ɢ���������������ּܷ�������ɣ���ѡ��C��
(3)ʹ������NaOH��Һ��Ͼ��ȵ���ȷ�����ǣ��������¶ȼ��ϵĻ��β������������ؽ�������ѡ��D��
(4)��3���¶Ȳ�ֱ�Ϊ��3.4����3.3����3.5����3����¶Ȳ�ƽ��ֵΪ3.4�����ʴ�Ϊ��3.4��
��50mL0.25mol/L������50mL0.55mol/L NaOH��Һ�����кͷ�Ӧ����ˮ�����ʵ���Ϊ0.05L �� 0.25 mol/L �� 2 = 0.025 mol����Һ������Ϊ100ml��1g/ml=100g���¶ȱ仯��ֵΪ��T=3.4����������0.025molˮ�ų�������ΪQ=mc��T=100g��4.18J/(g��)��3.4��=1421.2J����1.4212KJ������ʵ���õ��к�����H=-![]() =-56.8kJ/mol���ʴ�Ϊ��-56.8kJ/mol��
=-56.8kJ/mol���ʴ�Ϊ��-56.8kJ/mol��
��a��װ�ñ��¡�����Ч�����õ�����ƫС���к��ȵ���ֵƫС����a��ȷ��b����ȡNaOH��Һ�����ʱƽ�Ӷ�����ʵ�������ȷ����ʵ������Ӱ�죬��b����c���ֶ�ΰ�NaOH ��Һ����ʢ�������С�ձ��У�����ɢʧ�϶࣬����¶�ƫ�ͣ��к��ȵ���ֵƫС����c��ȷ��d�����¶ȼƲⶨNaOH��Һ��ʼ�¶Ⱥ�����һ֧�¶ȼƲⶨH2SO4��Һ���¶ȣ�ʵ�������ȷ����ʵ������Ӱ�죬��d���ʴ�Ϊ��ac��


 �ƸԴ��ž�ϵ�д�
�ƸԴ��ž�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���50mL����0.1molCl2����ˮ�еμ�2mol/L��NaOH��Һ���õ���ҺpH������NaOH��Һ����ı仯ͼ�����¡�����˵����ȷ���ǣ� ��

A����a��pH=4����c(Cl��)=m c(ClO��)����Ka(HClO)=![]()
B����x=100��b���Ӧ��Һ�У�c(OH��)��c(H+)������pH��ֽ�ⶨ��pH
C����y=200��c���Ӧ��Һ�У�c(OH��)��c(H+)=2c(Cl��)��c(HClO)
D��b~c�Σ���NaOH��Һ�ĵ��룬![]() ������
������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��a,b,c,dΪԭ��������������Ķ���������Ԫ�أ�aԭ�Ӻ������������bԭ�Ӵ����ĵ�������ͬ��c������������������ͬ��d��aͬ�壬����������ȷ����
A��ԭ�Ӱ뾶��d>c>b>a B��4��Ԫ����b�Ľ�������ǿ
C��c���������ˮ������ǿ�� D��d���ʵ������Ա�a���ʵ�������ǿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ֱ����������£�п���϶�ͭʱ������ͭ���� ��
A. ���� B. ���� C. ���� D. ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ԫ��W��X��Y��Z�����ڱ��е����λ�������ʾ��������Ԫ��ԭ�ӵ����������ֽ��Ϊ21�����й�ϵ��ȷ����
W | X | |||
Y | Z |
A���⻯��е㣺W<Z B���������Ӧˮ��������ԣ�Y>W
C���������۵㣺Y2X3<YZ3 D�������ӵİ뾶��Y<X
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2017 ������������ҹ�������Ϊ����Լ��Լ������Դ,������ɫ��Լ����������������Ӧ�ᳫ����
A.�����趨�յ��¶Ⱦ����ܵĵ�
B.�ƹ�ʹ��һ�������ϴ���ֽ��
C.�ٿ�˽�ҳ���˹�����ͨ����
D.����Ʒ���к�����װ�ٽ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�������������;���ж�Ӧ��ϵ����
A. Na2O2����CO2����O2 ��������������߹�����
B. ClO2���л�ԭ��������������ˮ��ɱ������
C. SiO2Ӳ�ȴ���������������ά
D. NH3������ˮ�������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������300mL1mol��L��1��������Ƭ�ķ�Ӧ��������ʹ��Ӧ���ʼӿ�Ĵ�ʩ��
A. �����¶�
B. �ټ�300mL1mol��L��1����
C. �õ�����Ƭ��������
D. ����100mL98%������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����2�����ܱ������У��������·�Ӧ��2A��g����B��g��![]() 2C��g����D��g��������������A��B����4 mol����ǰ10����A��ƽ����Ӧ����Ϊ0.12 mol/��L��s������10����ʱ��������B�����ʵ�����
2C��g����D��g��������������A��B����4 mol����ǰ10����A��ƽ����Ӧ����Ϊ0.12 mol/��L��s������10����ʱ��������B�����ʵ�����
A. 1.2 mol B. 1.6 mol C. 2.4 mol D. 2.8 mol
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com