
【题目】在直流电的作用下,锌板上镀铜时,金属铜作( )
A. 阴极 B. 阳极 C. 正极 D. 负极
 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源: 题型:
【题目】将2.32g Na2CO3、NaOH的固体混合物完全溶解于水,制成溶液,然后向该溶液中逐滴加入1mol / L的盐酸,所加盐酸的体积与产生CO2的体积(标准状况)关系如下图所示,下列说法中错误的是 ( )

A.OA段发生反应的离子方程式为: H++OH-= H2O、CO32-+H+=HCO3-
B.当加入35 mL盐酸时,产生CO2的体积为224 mL
C .A点溶液中的溶质为NaCl、Na HCO3
D.混合物中NaOH的质量0.60g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:4HCl(g)+O2(g)=2Cl2(g)+2H2O(g) ΔH=-123 kJ·mol-1。其中相关的化学键键能数据如下:
化学键 | H—Cl | O===O | Cl—Cl | H—O |
E/ kJ·mol-1 | 431 | 497 | a | 465 |
其中a值为( )
A. 242 B. 303.5 C. 180.5 D. 365
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列性质的比较正确的是( )
A.酸性:H2SiO3>H2CO3
B.碱性:Mg(OH)2>Al(OH)3
C.稳定性:SiH4>PH3
D.原子半径:N>C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是
A.石灰石溶于稀盐酸:CaCO3+2H+=Ca2++CO2↑+H2O
B.硫酸铜溶液与氢氧化钡溶液反应:Ba2++SO42-=BaSO4↓
C.氧化镁与稀硫酸:MgO+2H+=Mg2++H2O
D.常温下,将铜片插入硝酸银溶液中:Cu+Ag+=Cu2++Ag
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图装置测定中和热的实验步骤如下:
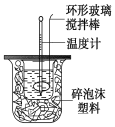
①用量筒量取50 mL 0.25 mol/L硫酸倒入小烧杯中,测出硫酸温度;
②用另一量筒量取50 mL 0.55 mol/L NaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度。
回答下列问题:
(1)写出稀硫酸和稀氢氧化钠溶液反应,表示中和热的热化学方程式(中和热数值为57.3 kJ/mol) 。
(2)倒入NaOH溶液的正确操作是 (从下列选出)。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(3)使硫酸与NaOH溶液混合均匀的正确操作是 (从下列选出)。
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃棒搅拌棒轻轻地搅动
(4)实验数据如下表:
①请填写下表中的温度差平均值:
温度 实验次数 | 起始温度 t1/℃ | 终止温度t2/℃ | 温度差平均值(t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 29.5 | |
2 | 25.9 | 25.9 | 25.9 | 29.2 | |
3 | 26.4 | 26.2 | 26.3 | 29.8 | |
②近似认为0.55 mol/L NaOH溶液和0.25 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃),则中和热ΔH= (取小数点后一位)。
③上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是(填字母) 。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时平视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后,用另一支温度计测定H2SO4溶液的温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下将0.2 mol气体A充入10 L恒容密闭容器中,进行反应2A(g)+ B(g)![]() 2C(g)+D(s) △H<0,一段时间后反应达到平衡。此反应过程中测定的数据如下表所示,则下列说法正确的是( )
2C(g)+D(s) △H<0,一段时间后反应达到平衡。此反应过程中测定的数据如下表所示,则下列说法正确的是( )
t/min | 2 | 4 | 6 | 8 | 10 |
n(A)/mol | 0.16 | 0.13 | 0.11 | 0.10 | 0.10 |
A.反应前2min的平均速率ν(C)=0.02mol·L-1·min-1
B.平衡后降低温度,反应达到新平衡前ν(逆)> ν(正)
C.其他条件不变,10min后再充入一定量的A,平衡正向移动,A的转化率变小
D.保持其他条件不变,反应在恒压下进行,平衡时A的体积分数与恒容条件下反应相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.常温下,反应C(s)+CO2(g)=2CO(g)不能自发进行,则该反应的ΔH > 0
B.已知2CO(g)+O2(g) = 2CO2(g) ΔH=-566 kJ·mol-1,则CO的燃烧热ΔH=-283 kJ
C.已知H+(aq)+OH-(aq)== H2O(l) ΔH=-57.3 kJ·mol-1,则稀H2SO4溶液和稀Ba(OH)2 溶液反应的反应热ΔH ==2×(-57.3) kJ·mol-1
D.500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) △H=-38.6 kJ·mol-1
2NH3(g) △H=-38.6 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com