
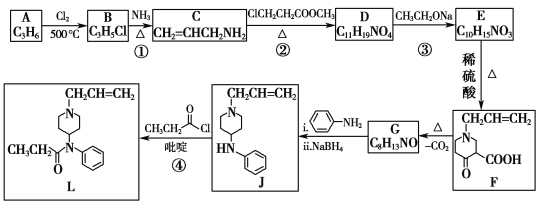
【题目】芬太尼类似物L具有镇痛作用,它的合成方法如图:
已知:
Ⅰ.![]() +Cl—R3
+Cl—R3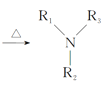 +HCl
+HCl
Ⅱ.R1COOR2+R3CH2COOR4![]()
![]() +R2OH
+R2OH
Ⅲ.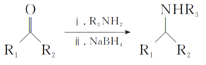 (R1、R2、R3、R4为氢原子或烃基)
(R1、R2、R3、R4为氢原子或烃基)
Ⅳ.RCH=CHR′![]() RCOOH+R′COOH,R、R′为烃基。
RCOOH+R′COOH,R、R′为烃基。
回答下列问题:
(1)A是一种烯烃,化学名称为__,其分子中最多有__个原子共面。
(2)B中官能团的名称为__、__。②的反应类型为__。
(3)③的化学方程式为__。
(4)碳原子上连有4个不同的原子或基团时,该碳原子称为手性碳原子。用星号(*)标出F中的手性碳原子__。G的结构简式为__,符合以下条件的G同分异构体有___种。
①能发生银镜反应
②结构中只含有一个环,该环结构为![]() ,环上只有一个侧链
,环上只有一个侧链
(5)已知④有一定的反应限度,反应进行时加入吡啶(一种有机碱),其作用是__。
(6)参照上述合成路线,写出以环己烯(![]() )和乙醇为起始原料制备化合物
)和乙醇为起始原料制备化合物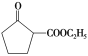 的合成路线(其他试剂任选)。___。
的合成路线(其他试剂任选)。___。
【答案】丙烯 7 碳碳双键 碳氯键 取代反应 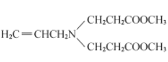
![]()
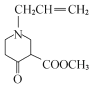 +CH3OH
+CH3OH 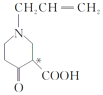
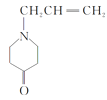 8 吸收反应生成的HCl,提高反应转化率
8 吸收反应生成的HCl,提高反应转化率 ![]()
【解析】
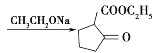
A是一种烯烃,由A、B的分子式,C的结构简式,可知A为CH3CH=CH2,A发生取代反应生成B为ClCH2CH=CH2;由C的结构简式,以及反应②的条件,可知反应②发生信息I中取代反应,则D为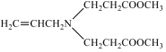 ;根据D的结构以及反应③的条件,可知反应③为信息II中的取代反应,结合E的分子式,可知E为
;根据D的结构以及反应③的条件,可知反应③为信息II中的取代反应,结合E的分子式,可知E为 ;E发生酯的水解反应生成F,对比F、J的结合,可知F脱羧生成G,G与苯胺脱去1分子水生成J,故G为
;E发生酯的水解反应生成F,对比F、J的结合,可知F脱羧生成G,G与苯胺脱去1分子水生成J,故G为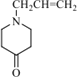 ;J与
;J与![]() 发生消去反应生成L。
发生消去反应生成L。
(1)根据分析可知A的结构简式为CH2=CH-CH3,A名称为:丙烯;旋转碳碳单键可以使甲基中1个H原子处于碳碳双键的平面结构内,分子中最多有7个原子共面;
(2)B为ClCH2CH=CH2,B中官能团有碳碳双键、碳氯键(氯原子),反应②是B的氨基中氢原子被-CH2CH2COOCH3替代,属于取代反应;
(3)反应③与信息II反应类似,化学方程式为:
![]()
 +CH3OH;
+CH3OH;
(4)用星号(*)标出F中的手性碳原子为: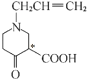 ;
;
根据分析可知G的结构简式为: ;
;
G的同分异构体满足:
①能发生银镜反应,说明含有—CHO;
②结构中只含有一个环,该环结构为![]() ,环上只有一个侧链,则其侧链可以为—CH=CH2CHO或—C(CHO)=CH2,环上有4种环境的氢,所以共有8种同分异构体;
,环上只有一个侧链,则其侧链可以为—CH=CH2CHO或—C(CHO)=CH2,环上有4种环境的氢,所以共有8种同分异构体;
(5)反应④为取代反应,生成有机物的同时可生成HCl,而吡啶呈碱性,可与HCl发生中和反应,使平衡正向移动,提高J的产率;
(6)由信息II可知,由![]() 反应得到
反应得到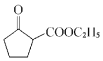 ;
;![]() 用酸性高锰酸钾溶液氧化可以生成己二酸,己二酸与乙醇发生酯化反应得到
用酸性高锰酸钾溶液氧化可以生成己二酸,己二酸与乙醇发生酯化反应得到![]() ;合成路线流程图为:
;合成路线流程图为: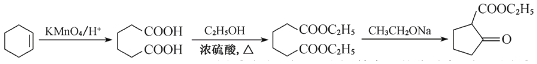 。
。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】美托洛尔可用于治疗高血压及心绞痛,某合成路线如下:

已知:R1OH+R2-Cl![]() R1OR2+HCl
R1OR2+HCl
(1)写出化合物C中的含氧官能团名称___________。
(2)下列说法正确的是___________。
A.C→D的反应类型是氧化反应
B.G的分子式为C12H14O3
C.试剂X在NaOH溶液中能水解
D.美托洛尔既能与盐酸反应又能与Na2CO3溶液反应
(3)写出E→F的化学方程式_______。
(4)写出化合物B的相邻同系物(C9H10O2)的同分异构体结构简式,且必须符合下列条件:_。
①含有苯环,能发生银镜反应 ②1H—NMR表明,分子中共有4种H原子
(5)结合题中信息,请设计以苯甲酸和苯酚为原料制备![]() 的合成路线(用流程图表示,无机试剂任选)_____________。
的合成路线(用流程图表示,无机试剂任选)_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业合成氨与制备硝酸一般可连续生产,流程如下:
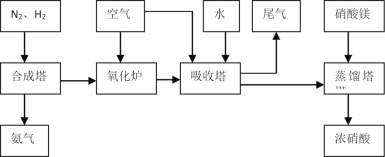
(1)工业生产时,制取氢气的一个反应为:CO(g)+H2O(g)![]() CO2(g)+H2(g)。
CO2(g)+H2(g)。
①t℃时,往1L密闭容器中充入0.2molCO和0.3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。该温度下此反应的平衡常数K=___。
②保持温度不变,向上述平衡体系中再加入0.1molCO,当反应重新建立平衡时,水蒸气的总转化率α(H2O)=___。
(2)合成塔中发生反应为:N2(g)+3H2(g)![]() 2NH3(g) △H<0。下表为不同温度下该反应的平衡常数。由此可推知,表中T1___573K(填“>”、“<”或“=”)。
2NH3(g) △H<0。下表为不同温度下该反应的平衡常数。由此可推知,表中T1___573K(填“>”、“<”或“=”)。
T/K | T1 | 573 | T2 |
K | 1.00×107 | 2.45×105 | 1.88×103 |
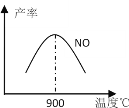
(3)NH3和O2在铂系催化剂作用下从145℃就开始反应:4NH3+5O2![]() 4NO+6H2O △H=-905kJ·mol-1 ,不同温度下NO产率如图所示。温度高于900℃时,NO产率下降的可能原因___。
4NO+6H2O △H=-905kJ·mol-1 ,不同温度下NO产率如图所示。温度高于900℃时,NO产率下降的可能原因___。
(4)吸收塔中反应为:3NO2+H2O![]() 2HNO3+NO。从生产流程看,吸收塔中需要补充空气,其原因是___。
2HNO3+NO。从生产流程看,吸收塔中需要补充空气,其原因是___。
(5)硝酸厂的尾气含有氮氧化物,不经处理直接排放将污染空气。目前科学家探索利用燃料气体中的甲烷等将氮氧化物还原为氮气和水,其反应机理为:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ·mol-1
则甲烷直接将NO2还原为N2的热化学方程式为:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在4 L密闭容器中充入6 mol A气体和5 mol B气体,在一定条件下发生反应:3A(g)+B(g)![]() 2C(g)+xD(g),5 s达到平衡。达到平衡时,生成了2 mol C,经测定D的浓度为0.5 mol·L-1,下列判断正确的是( )
2C(g)+xD(g),5 s达到平衡。达到平衡时,生成了2 mol C,经测定D的浓度为0.5 mol·L-1,下列判断正确的是( )
A. x=1B. B的转化率为20%
C. 平衡时A的浓度为1.50 mol·L-1D. B的平均反应速率为0.2 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合理利用或转化NO2、SO2、CO、NO等污染性气体是人们共同关注的课题。
Ⅰ.某化学课外小组查阅资料后得知:2NO(g)+O2(g)![]() 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:
①2NO(g)![]() N2O2(g)(快) v1正=k1正·c2(NO),v1逆=k1逆·c(N2O2) H1<0
N2O2(g)(快) v1正=k1正·c2(NO),v1逆=k1逆·c(N2O2) H1<0
②N2O2(g)+O2(g)![]() 2NO2(g)(慢) v2正=k2正·c(N2O2)·c(O2),v2逆=k2逆·c2(NO2) H2<0
2NO2(g)(慢) v2正=k2正·c(N2O2)·c(O2),v2逆=k2逆·c2(NO2) H2<0
请回答下列问题:

(1)反应2NO(g)+O2(g)![]() 2NO2(g)的H=________________(用含H1和H2的式子表示)。一定温度下,反应2NO(g)+O2(g)
2NO2(g)的H=________________(用含H1和H2的式子表示)。一定温度下,反应2NO(g)+O2(g)![]() 2NO2(g)达到平衡状态,写出用k1正、k1逆、k2正、k2逆表示平衡常数的表达式K=_____________________。
2NO2(g)达到平衡状态,写出用k1正、k1逆、k2正、k2逆表示平衡常数的表达式K=_____________________。
(2)决定2NO(g)+O2(g)![]() 2NO2(g)反应速率是反应②,反应①的活化能E1与反应②的活化能E2的大小关系为E1________E2(填“>”、“<”或“=”)。
2NO2(g)反应速率是反应②,反应①的活化能E1与反应②的活化能E2的大小关系为E1________E2(填“>”、“<”或“=”)。
Ⅱ.(3)反应N2O4(g)![]() 2NO2(g),在一定条件下N2O4与NO2的消耗速率与自身压强有如下关系:v(N2O4)=k1·p(N2O4),v(NO2)=k2·p2(NO2)。其中k1、k2是与温度有关的常数。一定温度下,相应的速率与压强关系如图所示,在图中标出的点中,能表示该反应达到平衡状态的两个点是_______________,理由是__________________________________________________________________________________________。
2NO2(g),在一定条件下N2O4与NO2的消耗速率与自身压强有如下关系:v(N2O4)=k1·p(N2O4),v(NO2)=k2·p2(NO2)。其中k1、k2是与温度有关的常数。一定温度下,相应的速率与压强关系如图所示,在图中标出的点中,能表示该反应达到平衡状态的两个点是_______________,理由是__________________________________________________________________________________________。
(4)在25℃时,将a mol·L-1的氨水溶液与0.02 mol·L-1 HCl溶液等体积混合后溶液恰好呈中性(忽略溶液混合后体积的变化),用含a的表达式表示250C时NH3·H2O的电离常数Kb=_________________。用质量分数为17%,密度为0.93 g/cm3的氨水,配制200 mL a mol·L-1的氨水溶液,所需原氨水的体积V=___________mL。
(5)如图电解装置可将雾霾中的NO、SO2分别转化为NH4+和SO42-。物质A的化学式为_________,阴极的电极反应式是__________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物D,质谱图表明其相对分子质量为86,将8.6gD完全燃烧的产物依次通过装有浓硫酸和碱石灰的装置,浓硫酸中增重9g,碱石灰中增重22g.其相关反应如图所示,其中B、D、E的结构中均含有2个﹣CH3,它们的核磁共振氢谱中均出现4个峰。
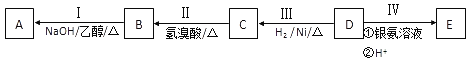
请回答:
(1)B中所含官能团的名称为________;D的分子式为________;
(2)Ⅲ的反应类型为________(填字母序号);
a.还原反应 b.加成反应 c.氧化反应 d.消去反应
(3)写出下列反应的化学方程式:
Ⅰ:___________________________________;
Ⅳ:__________________________________;
(4)C和E可在一定条件下反应生成F,F为有香味的有机化合物,该反应的化学方程式为________________________;
(5)A的同分异构体中有一对互为顺反异构,且结构中有2个﹣CH3 , 它们的结构简式为________和________;
(6)E的另一种同分异构体能发生银镜反应,能与足量金属钠生成氢气,不能发生消去反应,其结构简式为________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值。如图表示N2O在Pt2O+表面与CO反应转化成无害气体的过程。下列说法正确的是

A.N2O转化成无害气体时的催化剂是Pt2O2+
B.每1mol Pt2O+转化为Pt2O2+得电子数为3NA
C.将生成的CO2通人含大量SiO32-、Na+、Cl-的溶液中,无明显现象
D.1g CO2 、N2O的混合气体中含有电子数为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛是一种性能非常优越的金属,21世纪将是钛的世纪。
(1)TiO2薄膜中掺杂铬能显著提高光催化活性。基态Ti原子的价电子排布图为___________。
(2)四乙醇钛能增加橡胶在金属表面的粘附性。其制备原理如下:TiCl4+4CH3CH2OH+4NH3=Ti(OCH2CH3)4+4NH4Cl。
①Ti(OCH2CH3)4可溶于有机溶剂,常温下为淡黄色透明液体,其晶体类型为_________。
②N和O位于同一周期,O的第二电离能大于N的第二电离能的原因是___________。
③NH4Cl中存在的作用力有________,NH4Cl熔沸点高于CH3CH2OH的原因是________,Ti(OCH2CH3)4分子中C原子的杂化形式均为__________。
(3)钛酸锶(SrTiO3)可作电子陶瓷材料和人造宝石,其中一种晶胞结构如图所示。若Ti位于顶点位置,O位于__________位置;已知晶胞参数为a nm,Ti位于O所形成的正八面体的体心,则该八面体的边长为__________m(列出表达式)。
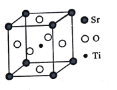
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钼(Mo)在工业和国防建设中有重要的作用。钼的常见化合价为+4、+5、+6。由钼精矿(主要成分是MoS2)制备单质钼和钼酸钠晶体(![]() ),部分流程如下图所示:
),部分流程如下图所示:
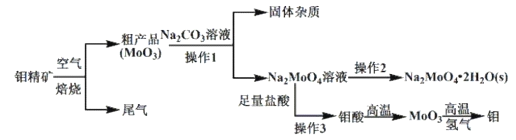
已知:钼酸微溶于水,可溶于碱溶液。
回答下列问题:
(1)钼精矿在空气中焙烧时,发生的主要方程式为_______________________。
(2)钼精矿焙烧时排放的尾气对环境会产生危害,请你提出一种实验室除去该尾气的方法________________________。
(3)操作2的名称为_____________________ 、过滤、洗涤、干燥。
(4)实验室由钼酸经高温制MoO3,所用到的硅酸盐材料仪器的名称是_________。
(5)操作1中,加入碳酸钠溶液充分反应后,碱浸液中c(![]() )=0.80 molL1、c(
)=0.80 molL1、c(![]() )=0.05 molL1,在结晶前需加入Ba(OH)2固体以除去溶液中的
)=0.05 molL1,在结晶前需加入Ba(OH)2固体以除去溶液中的![]() 。当BaMoO4开始沉淀时,SO42的去除率是_________。[Ksp(BaSO4)=1.1
。当BaMoO4开始沉淀时,SO42的去除率是_________。[Ksp(BaSO4)=1.1![]() 1010、Ksp(BaMoO4)=4.0
1010、Ksp(BaMoO4)=4.0![]() 108,溶液体积变化可忽略不计。]
108,溶液体积变化可忽略不计。]
(6)焙烧钼精矿所用装置是多层焙烧炉,下图为各炉层固体物料的物质的量的百分数(![]() )。
)。
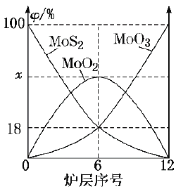
①x=___________。
②焙烧炉中也会发生MoS2与MoO3反应生成MoO2和SO2,还原剂为_________。若反应中转移3mole-,则消耗的还原剂的物质的量为______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com