
【题目】在4 L密闭容器中充入6 mol A气体和5 mol B气体,在一定条件下发生反应:3A(g)+B(g)![]() 2C(g)+xD(g),5 s达到平衡。达到平衡时,生成了2 mol C,经测定D的浓度为0.5 mol·L-1,下列判断正确的是( )
2C(g)+xD(g),5 s达到平衡。达到平衡时,生成了2 mol C,经测定D的浓度为0.5 mol·L-1,下列判断正确的是( )
A. x=1B. B的转化率为20%
C. 平衡时A的浓度为1.50 mol·L-1D. B的平均反应速率为0.2 mol·L-1·s-1
 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案科目:高中化学 来源: 题型:
【题目】在20mL bmol·L﹣1KOH溶液中逐滴加入0.1mol·L﹣1醋酸溶液,溶液pH和加入醋酸的体积关系曲线如图所示,下列关系不正确的是
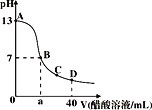
A. a=20
B. b=0.1
C. 在C点:c(CH3COO﹣)>c(K+)>c(H+)>c(OH﹣)
D. 在D点:c(CH3COO﹣)+c(CH3COOH)=2c(K+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,下列叙述不能作为可逆反应A(g)+3B(g)![]() 2C(g)达到平衡状态标志的是( )
2C(g)达到平衡状态标志的是( )
①C的生成速率与C的消耗速率相等 ②单位时间内生成amol A,同时生成3amol B ③A、B、C的浓度不再变化 ④C的物质的量不再变化 ⑤混合气体的总压强不再变化 ⑥混合气体的总物质的量不再变化 ⑦单位时间消耗amol A,同时生成3amol B ⑧A、B、C的分子数之比为1∶3∶2
A. ②⑧ B. ④⑦ C. ①③ D. ⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全国平板玻璃生产企业大气污染物年排放总量逐年增加,对氮氧化物(NOx)排放的控制与监测已刻不容缓。回答下列问题
(1)平板玻璃熔窑烟气中的NOx以温度型氮氧化物为主。其中NO在空气中容易被一种三原子气体单质氧化剂和光化学作用氧化成NO2,该氧化剂的分子式为___________。
(2)用CH4催化还原NOx可在一定程度上消除氮氧化物的污染。
已知:CH4(g)+4NO2(g)![]() 4NO(g)+CO2(g)+2H2O(g) △H=-574kJ·mol-1
4NO(g)+CO2(g)+2H2O(g) △H=-574kJ·mol-1
2NO2(g)+N2(g)![]() 4NO(g) △H=+293kJ·mol-1
4NO(g) △H=+293kJ·mol-1
则反应CH4(g)+4NO(g)![]() 2N2(g)+CO2(g)+2H2O(g)的△H=___________kJ·mol-1
2N2(g)+CO2(g)+2H2O(g)的△H=___________kJ·mol-1
(3)800℃时,在刚性反应器中以投料比为1︰1的NO(g)与O2(g)反应:

其中NO2二聚为N2O4的反应可以迅速达到平衡。体系的总压强p随时间t的变化如下表所示[t=∞时,NO(g)完全反应]。

①NO(g)与O2(g)合成的反应速率v=4.2×10-2×p2(NO)×p(O2)(kPa·min-1),t=52min时,测得体系中p(O2)=11.4kPa,则此时的p(NO)=___________kPa, v=___________kPa·min-1(计算结果保留1位小数)。
②若升高反应温度至900℃,则NO(g)与O2(g)完全反应后体系压强p∞(900℃)______(填“大于”等于”或“小于”)22.3kPa,原因是______________________。
③800℃时,反应N2O4(g)![]() 2NO2(g)的平衡常数Kp=___________kPa(Kp为以分压表示的平衡常数,计算结果保留2位小数)。
2NO2(g)的平衡常数Kp=___________kPa(Kp为以分压表示的平衡常数,计算结果保留2位小数)。
(4)对于反应2NO(g)+O2(g)→2NO2(g),科研工作者提出如下反应历程:
第一步:2NO(g)![]() N2O2(g) 快速平衡
N2O2(g) 快速平衡
第二步:N2O2+O2(g)→2NO2(g) 慢反应
下列表述正确的是___________(填标号)。
A.v(第一步的逆反应)>v第二步反应
B.反应的中间产物为N2O2
C.第二步中N2O2与O2的碰撞全部有效
D.第二步反应活化能较低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是一套电化学实验装置,图中C、D均为铂电极,U为盐桥,G是灵敏电流计,其指针总是偏向电源正极。

(1)As(砷)位于元素周期表中第4周期第ⅤA族,则Na3AsO4溶液的pH_________(填“>”“<”或“=”)7。
(2)向B杯中加入适量较浓的硫酸,发现G的指针向右偏移。此时A杯中的主要实验现象是_____,D电极上的电极反应式为___________。
(3)一段时间后,再向B杯中加入适量的质量分数为40%的氢氧化钠溶液,发现G的指针向左偏移。此时整套实验装置的总的离子方程式为________________。
(4)再过一段时间后,G的指针逐渐归零,此时实验装置中的化学反应已经达到化学平衡状态,该反应的化学平衡常数的表达式为:K=________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)元素周期表体现了元素周期律,元素周期律的本质是原子核外电子排布的周期性变化。
①下表中的实线是元素周期表的部分边界。请在表中用实线补全周期表的边界_____________。

②元素甲是第三周期第VIA族元索,请在右边方框中按上图中氢元素的样式写出元素甲的原子序数、元素符号、元素名称和相对原子质量(取整数)________________。
③元素乙的M层电子数比K层电子数多1,则乙原子半径与甲原子半径比较: _______>________(用元素符号表示)。甲、乙的最高价氧化物对应的水化物的酸性强弱为_______>________(用化学式表示)。
④请写出55号元素在元素周期表中的位置:_______________________________
(2) 工业合成氨的反应N2(g)+ 3H2(g)![]() 2NH3(g)是一个可逆反应、反应条件是高温、 高压,并且需要合适的催化剂。已知形成1mol H一H键、1mol N一H键、Imol
2NH3(g)是一个可逆反应、反应条件是高温、 高压,并且需要合适的催化剂。已知形成1mol H一H键、1mol N一H键、Imol ![]() 键放出的能量分别为436kJ、391kJ、946kJ。
键放出的能量分别为436kJ、391kJ、946kJ。
①若1mol N2完全反应生成NH3可____________(填“吸收”或“放出”)热量_________ kJ。
②如果将1mol N2和3mol H2混合,在一定条件下使其充分反应,测得的热量数值总小于上述数值,
其原因是_______________________________________________________________
③实验室模拟工业合成氨时,在容积为2L的密闭容器中进行,反应经过10min后,生成10molNH3则用N2表示的化学反应速率是_______________![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或表示方法正确的是
A. 由C(石墨,s)=C(金刚石,s)ΔH = +1.9 kJ·mol-1可知,金刚石比石墨稳定
B. 已知S(g)+O2(g)═SO2(g) ΔΗ1 ;S(s)+O2(g)═SO2(g) ΔΗ2 ,则ΔΗ1<ΔΗ2
C. 在101kPa时,2g H2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)![]() 2H2O(l) ΔH = +285.8 kJ·mol-1
2H2O(l) ΔH = +285.8 kJ·mol-1
D. 在稀溶液中:H +(aq)+OH -(aq)= H2O(l)ΔH =-57.3 kJ·mol-1,若将含1mol CH3COOH与含1mol NaOH的溶液混合,放出的热量等于57.3 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中甲池是以甲醇为原料,KOH为电解质的高效燃料电池,电化学过程的如图,下列说法中不正确的是

A. 甲池的总反应式为:2CH3OH+3O2+4KOH=2K2CO3+6H2O
B. 若乙池中为足量AgNO3溶液,则阳极的电极反应为: 4OH--4e-= 2H2O+O2↑
C. 甲池中随着反应的不断进行,溶液的pH减小
D. 若乙池中为一定量CuSO4溶液,通电一段时间后,向溶液中加入0.1mol Cu(OH)2后恰好恢复到电解前的浓度和pH,则电解过程中转移的电子数为0.2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com