
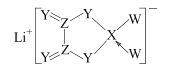
【题目】W、X、Y、Z 是同周期主族元素,Y的最外层电子数是X次外层电子数的3倍,四种元素与锂组成的盐是一种新型电池的电解质(结构如图,箭头指向表示共用电子对由W提供,阴离子中所有原子均达到8e-稳定结构)。下列说法不正确的是
A.该物质中含离子键、极性键和非极性键
B.在四种元素中W的非金属性最强
C.Y和Z两元素形成的化合物不止一种
D.四种元素的原子半径中Z的半径最大
【答案】D
【解析】
W、X、Y、Z是同周期主族元素,Y的最外层电子数是X次外层电子数的3倍,可知X有2个电子层,四种元素都是第二周期的元素,X的次外层电子数只能为2,Y的最外层电子数为6,Y为O元素;由四种元素与锂组成的盐是一种新型的锂离子电池的电解质,Z可形成4对共用电子对,Y可形成2对共用电子对,X可形成3对共用电子对和1个配位键(接受孤电子对),则Z为C元素、、X为B元素,W可提供孤电子对,且形成1对共用电子对,则W为F元素,以此来解答。
由上述分析可知,W为F、X为B、Y为O、Z为C元素。
A. 该化合物是离子化合物,含离子键,在阴离子中含有不同种元素原子之间形成的极性共价键,阴离子中含有C原子之间的非极性共价键及F、B原子之间的配位键,配位键属于极性共价键,A正确;
B. 同一周期的元素,原子序数越大,元素的非金属性越强,在这四种元素中非金属性最强的元素是F元素,B正确;
C. C、O元素可形成CO、CO2等化合物,故二者形成的化合物种类不止一种,C正确;
D. 同一周期的元素原子序数越大,原子半径越小,在上述元素中B元素原子序数最小,故四种元素的原子半径中B的半径最大,D错误;
故答案选D。


科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种元素的原子序数依次增大,A的最高正价和最低负价的绝对值相等,B的基态原子有3个不同的能级且各能级中电子数相等,D的基态原子与B的基态原子的未成对电子数目相同,E的基态原子的电子总数与p能级的电子数相等,F的基态原子的3d轨道电子数是4s电子数的4倍。请回答下列问题:
(1)F的基态原子价电子排布式为____________________ 。
(2)B、C、D、E的原子的第一电离能由小到大的顺序为_______________(用元素符号回答)
(3)下列关于B2A2分子和A2D2分子的说法正确的是______________
A 分子中都含有σ键和π键
B 中心原子都sp杂化
C 都是含极性键和非极性键的非极性分子
D 互为等电子体
E.B2A2分子的沸点明显低于A2D2分子
(4)F2+能与BD分子形成[F(BD)4]2+,其原因是BD分子中含有_________
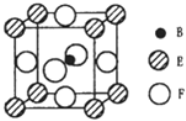
(5)由B、E、F三种元素形成的一种具有超导性的晶体,晶胞如图所示.B位于E和F原子紧密堆积所形成的空隙当中.与一个F原子距离最近的F原子的数目为_________,该晶体的化学式为_______.若该晶体的相对分子质量为M,阿伏加德罗常数为NA,B、E、F三种元素的原子半径分别为r1pm、r2pm、r3pm,则该晶体的密度表达式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的量是高中化学常用的物理量,请完成以下有关计算。
(1)含500mL 0.8 mol/L 的Al2(SO4)3中所含的SO![]() 的物质的量是___________。
的物质的量是___________。
(2)标准状况下,___________ L NH3所含氢原子数与0.2molH3PO4所含氢原子数相等。
(3)将20ml物质的量浓度为6mol/L的MgSO4加水稀释成100ml溶液,所得稀硫酸的物质的量浓度是_____________。
(4)a个X原子的总质量为bg,则X的相对原子质量可以表示为_______________。
(5)同温同压下,同体积的甲烷(CH4)和二氧化碳分子数之比为__________,质量之比为__________。
(6)等质量的 SO2 和 SO3 物质的量之比是____________,氧原子数之比为____________。
(7)25.4 g某二价金属A的氯化物中含有0.4mol Cl-,则A的摩尔质量为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对矿井下空气进行氧气含量测定既能保证矿工的身体健康又能为瓦斯灾害处理提供数据。缺氧场所常采用伽伐尼电池型氧传感器检测氧气浓度,该传感器结构如图所示,工作电极为Pb,对比电极为Pt,电池液为KOH溶液。下列说法不正确的是

A.氧在对比电极被还原
B.工作电极的电极反应为Pb+2OH--2e-=Pb(OH)2
C.外电路电子由对比电极流向工作电极
D.该传感器测定氧气浓度时不需外加电源
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为验证卤素单质氧化性的相对强弱,某小组用如图所示装置进行实验(夹持仪器已略去,气密性已检验)。
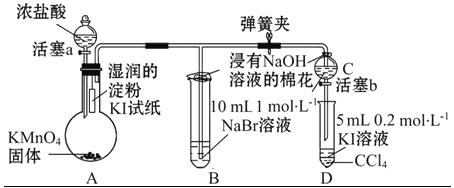
实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当B中溶液由黄色变为棕红色时,关闭活塞a。
Ⅳ.……
(1)A中产生黄绿色气体,其电子式是_________________。
(2)验证氯气的氧化性强于碘的实验现象是_____________________________。
(3)B中溶液发生反应的离子方程式是_________________________。
(4)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是元素周期表的一部分,下列叙述不正确的是( )

A.Pb的最高正价为+4B.原子半径比较:Al>F
C.酸性强弱:H3AsO4<H2SeO4D.Br的最高价氧化物对应水化物的化学式为HBrO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W均为短周期元素,它们在元素周期表中相对位置如图所示。Z原子的最外层电子数是第一层电子数的3倍,下列说法中正确的是
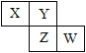
A. 原子半径:Z > Y > XB. 氢化物稳定性:X > Y
C. 氢化物沸点:Z > YD. 最高价氧化物对应的水化物酸性:W > Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从制溴苯的实验中分离出FeBr3溶液,得到溴的苯溶液和无水FeCl3。下列设计能达到相应实验目的的是

A.用装置甲制取氯气按图示通入装置乙中能使Br-全部转化为溴单质
B.用装置丙分液时先从下口放出水层,换一容器从上口倒出有机层
C.检验溶液中是否氧化完全,取水层少许滴加硝酸银溶液,看有无沉淀生成
D.用装置丁将分液后的水层溶液蒸发至有大量晶体析出时,停止加热,余热蒸干
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用KOH为电解质的循环阳极锌空气二次电池放电时的总反应为2Zn+O2=2ZnO,工作时,用泵将锌粉与电解液形成的浆料输入电池内部发生反应,反应所生成的产物随浆料流出电池后,被送至电池外部的电解槽中,经还原处理后再送入电池;循环阳极锌-空气二次电池工作流程图如图所示。下列说法错误的是( )

A.放电时,电池正极反应为O2+4e-+2H2O=4OH-
B.放电时,电解质中会生成少量碳酸盐
C.电池停止工作时,锌粉与电解质溶液不反应
D.充电时,电解槽阴极反应为ZnO+2e-+H2O=Zn+2OH-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com