
【题目】用KOH为电解质的循环阳极锌空气二次电池放电时的总反应为2Zn+O2=2ZnO,工作时,用泵将锌粉与电解液形成的浆料输入电池内部发生反应,反应所生成的产物随浆料流出电池后,被送至电池外部的电解槽中,经还原处理后再送入电池;循环阳极锌-空气二次电池工作流程图如图所示。下列说法错误的是( )

A.放电时,电池正极反应为O2+4e-+2H2O=4OH-
B.放电时,电解质中会生成少量碳酸盐
C.电池停止工作时,锌粉与电解质溶液不反应
D.充电时,电解槽阴极反应为ZnO+2e-+H2O=Zn+2OH-
 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:
【题目】W、X、Y、Z 是同周期主族元素,Y的最外层电子数是X次外层电子数的3倍,四种元素与锂组成的盐是一种新型电池的电解质(结构如图,箭头指向表示共用电子对由W提供,阴离子中所有原子均达到8e-稳定结构)。下列说法不正确的是
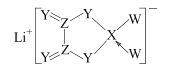
A.该物质中含离子键、极性键和非极性键
B.在四种元素中W的非金属性最强
C.Y和Z两元素形成的化合物不止一种
D.四种元素的原子半径中Z的半径最大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)写出实验室制NH3的化学方程式_________________;
(2)写出铅蓄电池的负极电极反应式__________________;
(3)写出Ba(OH)2·8H2O与NH4Cl晶体搅拌反应的化学方程式_______________;
(4)画出稀有气体氪的原子结构示意图__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合硫酸铁可用于水的净化,其化学式可表示为[Fea(OH)b(SO4)c]m。取一定量聚合硫酸铁样品与足量盐酸反应,将所得溶液平均分为两份。向一份溶液中加入足量的BaCl2溶液,得到白色沉淀1.747 5 g。取另一份溶液,先将Fe3+还原为Fe2+(还原剂不是Fe,且加入的还原剂恰好将Fe3+还原为Fe2+),再用0.020 00 mol/LK2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7标准溶液50.00 mL。该聚合硫酸铁样品中a∶b为[已知:K2Cr2O7+6FeSO4+7H2SO4=K2SO4+Cr2(SO4)3+3Fe2(SO4)3+7H2O]( )
A. 1∶1B. 2∶1C. 3∶1D. 2∶5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A. 在水玻璃溶液中通入少量CO2:SiO32-+2H2O+2CO2=H2SiO3↓+2HCO3-
B. 向0.1L5mol·L-1亚硫酸氢铵溶液中逐滴加入0.1L7mol·L-1 NaOH溶液:2NH![]() +5HSO3-+7OH-===2NH3·H2O+5SO
+5HSO3-+7OH-===2NH3·H2O+5SO![]() +5H2O
+5H2O
C. Mg(HCO3)2溶液中加入足量NaOH溶液:Mg2++2HCO3-+2OH-=MgCO3↓+CO32-+2H2O
D. 向Al2(SO4)3溶液中加入过量的NH3·H2O:Al3 ++4 NH3·H2O=AlO2-+2H2O+4NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠俗称大苏打、海波,主要用作照相业定影剂,还广泛应用于鞣革、媒染、化工、医药等行业。常温下,溶液中析出晶体为Na2S2O35H2O.Na2S2O35H2O于40-45℃熔化,48℃分解;Na2S2O3易溶于水,不溶于乙醇。在水中有关物质的溶解度曲线如图甲所示。
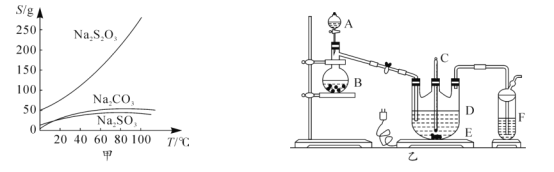
Ⅰ.制备Na2S2O35H2O
将硫化钠和碳酸钠按反应要求比例放入图乙装置D中,然后注入150mL蒸馏水使其溶解,再在分液漏斗A中注入一定浓度的H2SO4,在蒸馏烧瓶B中加入亚硫酸钠固体,并按图乙安装好装置。
(1)仪器D的名称为______
(2)打开分液漏斗活塞,注入H2SO4,使反应产生的气体较缓慢均匀地通入Na2S和Na2CO3的混合溶液中,并用磁力搅拌器搅动并加热,总反应方程式为2Na2S+Na2CO3+4SO2 ![]() 3Na2S2O3+CO2。
3Na2S2O3+CO2。
①烧瓶B中发生反应的化学方程式为______。
②将B中产生的气体缓慢均匀地通入D中的正确操作是______。
③制备过程中仪器D中的溶液要控制在弱碱性条件下,其理由是______(用离子方程式表示)。
Ⅱ.分离Na2S2O35H2O并测定含量

(3)操作I为趁热过滤,其目的是______;操作Ⅱ是过滤、洗涤、干燥,其中洗涤操作时用______(填试剂)作洗涤剂。
(4)蒸发浓缩滤液直至溶液中有少量晶体析出为止,蒸发时控制温度不宜过高的原因是______。
(5)制得的粗晶体中往往含有少量杂质。为了测定粗产品中Na2S2O35H2O的含量,称取1.25g的粗样品溶于水,配成250mL溶液,取25.00mL溶液于锥形瓶中,滴入几滴淀粉溶液,用0.0100mol/L标准I2溶液滴定,当溶液中S2O32-全部被氧化时,消耗碘溶液的体积为25.00mL.试回答:(提示:I2+2S2O32-═2I-+S4O62-)
①达到滴定终点时的现象:______
②产品中Na2S2O35H2O的质量分数为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在某恒容密闭容器中进行反应X(g) + 3Y(g)![]() 2Z(g),若X、Y、Z起始浓度分别为c1 mol/L、c2 mol/L、c3 mol/L(c1、c2、c3均大于0),当反应达平衡时X、Y、Z的浓度分别为0.1mol/L,0.3mol/L,0.08mol/L,则下列判断不合理的是
2Z(g),若X、Y、Z起始浓度分别为c1 mol/L、c2 mol/L、c3 mol/L(c1、c2、c3均大于0),当反应达平衡时X、Y、Z的浓度分别为0.1mol/L,0.3mol/L,0.08mol/L,则下列判断不合理的是
A. c1:c2 = 1:3
B. 当4v(X)正= v(Y)逆时,该反应还在向正反应方向建立平衡
C. c1可能为0.1
D. X、Y的转化率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究发现,可以用石墨作阳极、钛网作阴极、熔融的CaF2-CaO作电解质,利用图示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛。下列说法中错误的是
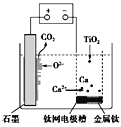
A. 在制备金属钛前后,整套装置中CaO的总量保持不变
B. 阳极的电极反应式为C+2O2--4e-===CO2↑
C. 由TiO2制得1 mol金属Ti,理论上外电路通过2 mol 电子
D. 若用铅蓄电池作供电电源,“—”接线柱应连接Pb电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应,H2O只作还原剂的是
A.2H2O![]() 2H2↑+O2↑B.2F2+2H2O=4HF+O2
2H2↑+O2↑B.2F2+2H2O=4HF+O2
C.CaO+ H2O=Ca(OH)2D.2Na2O2+2H2O=4NaOH+O2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com