
【题目】锂钒氧化物二次电池的成本较低,对环境无污染,能量密度远远高于其他电池,电池总反应为V2O5+xLi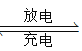 LixV2O5。下列说法合理的是
LixV2O5。下列说法合理的是
A. 电池在放电时,Li+向负极移动
B. 锂在放电时作正极,充电时作阳极
C. 该电池充电时阳极的反应为LixV2O5-xe-=V2O5+xLi+
D. V2O5只是锂发生反应的载体,不参与电池反应
科目:高中化学 来源: 题型:
【题目】一定温度下,在2L的密闭容器中,M、N两种气体的物质的量随时间变化的曲线如图所示:
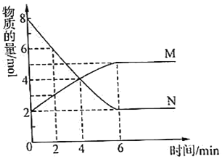
(1)反应的化学方程式为___。
(2)反应达到最大限度的时间是__min,该时间内的平均反应速率υ(N)=__。
(3)反应达到平衡状态时,放出6QkJ的热量。若容器开始时充入lmolN,反应放出的热量为__。
A.等于QkJ B.小于QkJ C.大于QkJ D.等于2QkJ
(4)判断该反应达到平衡状态的依据是___。
①该条件下,正逆反应速率都为零
②该条件下,混合气体的平均摩尔质量不再发生变化
③该条件下,混合气体的压强不再发生变化
④该条件下,单位时间内消耗2mol N的同时,生成1mol M
(5)能加快反应速率的措施是___。
①升高温度 ②容器体积不变,充入惰性气体Ar
③容器压强不变,充入惰性气体Ar ④使用催化剂
(6)一定温度下,将一定量的N2和H2充入2L固定体积的密闭容器中进行反应:N2(g)+3H2(g)![]() 2NH3(g)。若起始时向容器中充入10mol的N2和15mol的H2,10min时达到平衡,测得容器内NH3的浓度为2molL﹣1。10min时N2的转化率为___;平衡时的压强和起始时的压强之比为___。
2NH3(g)。若起始时向容器中充入10mol的N2和15mol的H2,10min时达到平衡,测得容器内NH3的浓度为2molL﹣1。10min时N2的转化率为___;平衡时的压强和起始时的压强之比为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中,A是固体金属单质,燃烧时火焰呈黄色。请回答下列问题:
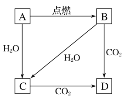
(1)写出B物质的化学式:_________
(2)画出A原子的结构示意图________________,该原子的最外电子层上只有1个电子,在化学反应中该电子很容易失去,因此其单质表现出很强的___________(填“氧化”或“还原”)性。
(3)写出下列转化的化学方程式:
A![]() C:__________________________________________________。
C:__________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
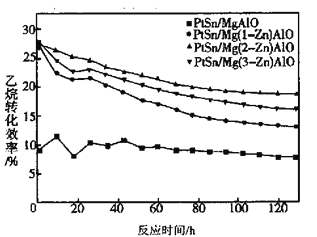
【题目】开发新型高效的乙烷脱氢制乙烯过程对于石油化工至关重要。回答下列问题:
(1)不同Zn含量PtSn催化剂催化乙烷脱氢反应![]()
![]() 时,乙烷的转化效率随时间变化如下图所示。由图可知,催化活性最优的催化剂为____________。
时,乙烷的转化效率随时间变化如下图所示。由图可知,催化活性最优的催化剂为____________。
(2)随着温度升高,乙烷脱氢反应容易造成催化剂表面积碳,影响催化剂的稳定性,脱氢时通常一起充入CO2,该工艺称为“乙烷二氧化碳氧化脱氢反应”,CO2发生的反应为:![]()
![]() 、
、![]()
![]() 。则CO2的作用为____________、____________。
。则CO2的作用为____________、____________。
(3)实验室模拟“乙烷二氧化碳氧化脱氢反应”,![]() ℃时,将2.8mol
℃时,将2.8mol![]() 与5.2mol CO2充入容积恒定为0.5L的恒温密闭容器中发生反应:
与5.2mol CO2充入容积恒定为0.5L的恒温密闭容器中发生反应:![]()
![]() ,平衡时,
,平衡时,![]() 。
。
①a=______。
②T℃时,该反应的平衡常数K=______。
③若不考虑副反应,对于该反应体系,下列说法正确的是______(填标号)。
a.三种生成物平衡分压比值保持不变时,反应达到平衡状态
b.降低C2H6与CO2用料比,C2H6的平衡转化率升高
c.在容器中加入CaO,可与H2O反应,提高CH2=CH2产率
d.反应开始后的一段时间内,适当缩小容器体积可提高单位时间内C2H6的转化率
(4)中国科学院科研团队,利用固体氧化物电解池(Solid oxide electrolysis cell,SOEC),在SOEC阳极实现了高选择性乙烷电化学脱氢制乙烯。装置示意图如下。

①b为电源的______极。
②阳极电极反应为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如右图所示。下列分析不正确的是( )

A. ①代表滴加H2SO4溶液的变化曲线
B. b点,溶液中大量存在的离子是Na+、OH–
C. c点,两溶液中含有相同量的OH–
D. a、d两点对应的溶液均显中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E分别是铁或铁的化合物。其中D是一种红褐色沉淀。其相互反应关系如图所示:

根据如图所示变化,按要求回答下列问题:
(1)写出A、E的化学式:A__,E__;
(2)写出其中几步反应的化学方程式:
C→B:___;
B→D:___;
E→A:___。
(3)C中加入NaOH溶液,看到的现象是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍。下列叙述正确的是(已知:氧化性Fe2+<Ni2+<Cu2+)( )
A. 电解后,电解槽底部的阳极泥中只有金属Pt
B. 电解过程中,电解质溶液的质量可能保持不变
C. 电解后,溶液中存在的金属阳离子只有Fe2+和Zn2+
D. 阳极发生氧化反应,其电极反应式:Ni2++2e-![]() Ni
Ni
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如下的实验装置。
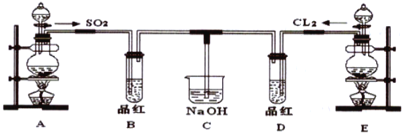
(1)写出Cu与浓硫酸制备SO2的化学方程式__________。
(2)实验室用装置E制备Cl2的离子方程式_________ 。指出该反应中HCl(浓)所表现出的化学性质__________、___________。
(3)①反应开始一段时间后,观察到B、D两个试管中的品红溶液出现__________的现象。
A品红都褪色 B品红都不褪色
C试管B 中品红褪色D 中不褪色 D试管D 中品红褪色B 中不褪色
②停止通气后,再给B、D两个试管分别加热,两个试管中的现象又分别为_____。
A 无色 红色 B 无色 无色 C 红色 红色 D 红色 无色
(4)C烧杯氢氧化钠溶液的作用是___________。
(5)另一个实验小组的同学认为SO2 和氯水都有漂白性,二者混合后的漂白性肯定会更强,他们将制得的SO2和Cl2按1∶1同时通入到品红溶液中,结果发现褪色效果并不像想象的那样。请你分析该现象的原因(用化学方程式表示)________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,一氧化碳和二氧化碳混合气体的质量为36 g,体积为22.4 L。
(1)混合气体中一氧化碳的体积是__________。
(2)混合气体中二氧化碳的物质的量是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com