
【题目】下图中,A是固体金属单质,燃烧时火焰呈黄色。请回答下列问题:
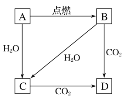
(1)写出B物质的化学式:_________
(2)画出A原子的结构示意图________________,该原子的最外电子层上只有1个电子,在化学反应中该电子很容易失去,因此其单质表现出很强的___________(填“氧化”或“还原”)性。
(3)写出下列转化的化学方程式:
A![]() C:__________________________________________________。
C:__________________________________________________。
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】某有机物B是芳香烃的含氧衍生物,其相对分子质量不超过120,B中含氧的质量分数为14.8%,B与NaOH溶液不发生反应。有机物A在一定条件下可发生反应A+H2O![]() B+C。有关C的转化关系如下图所示:
B+C。有关C的转化关系如下图所示:

已知:![]()
根据以上信息,回答下列问题:
(1)B的结构简式为___________________________,条件I、II中均需要的试剂为___________________。
(2)有关C的转化关系图中所发生的反应中属于取代反应的有_______个。
(3)C的同分异构体中,同时符合下列要求的物质有__________种。
a.苯环上有两个侧链 b.能发生银镜反应 c.能发生消去反应
(4)写出下列转化的化学方程式
F→E_________________________________;
F→G_________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取乙酸乙酯的装置如下图,按要求回答问题。
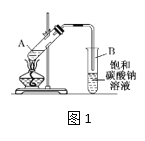
(1)写出制取乙酸乙酯的化学方程式_________________________。
(2)浓硫酸的作用是______,长导管末端不伸入饱和碳酸钠溶液的目的是______。
(3)上述实验中饱和碳酸钠溶液的作用是_______(填字母代号)。
A.反应掉乙酸和乙醇
B.反应掉乙酸并吸收部分乙醇
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中的更小,有利于分层析出
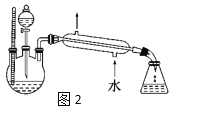
(4)某化学课外小组设计了图2所示的制取乙酸乙酯的装置(铁架台、铁夹、加热装置均已略去),与图1装置相比,此装置的主要优点有______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为1 L的密闭容器中,加入5 mol A物质,在一定条件下同时发生下列两个反应:①2A(g)![]() 2B(g)+C(g);②A(g)
2B(g)+C(g);②A(g)![]() C(g)+D(g),当达到平衡时,测得c(A)= 2.5 mol/L,c(C)=2.0 mol/L.,则下列说法中正确的是
C(g)+D(g),当达到平衡时,测得c(A)= 2.5 mol/L,c(C)=2.0 mol/L.,则下列说法中正确的是
A.达到平衡时A的总转化率为40%
B.达到平衡时c(B)为1.0 mol/L
C.达到平衡时c(B)=2c(D)
D.达到平衡时c(D)=2c(B)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于酸碱中和滴定实验的说法正确的是( )
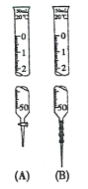
A.用图B的滴定管可准确量取25.00mL的酸性KMnO4溶液
B.滴定过程中,眼睛要时刻注视滴定管中液面的变化
C.滴定管装入液体前需用待装液润洗
D.滴定前平视,滴定结束后仰视读数,不影响测定结果
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】改变0.1mol/L二元弱酸H2A溶液的pH,溶液中的H2A、HA-、A2-的物质的量分数![]() 随pH的变化如图所示已知[
随pH的变化如图所示已知[![]() ]。
]。
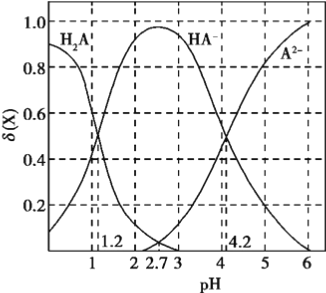
下列叙述错误的是
A. lg[K2(H2A)]=-4.2
B. pH=4.2时,c(HA-) = c(A2-) = c(H+)
C. pH=2.7时,c(HA-)>c(H2A)= c(A2-)
D. pH=1.2时,c(H2A)=c(HA-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】查阅资料:元素铬(Cr)在溶液中主要以Cr3+(蓝紫色) 、Cr(OH)4-(绿色) 、Cr2O72(橙红色)、CrO42(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:
(1)铬(24Cr)属于________(选填编号)。
a.主族元素 b.副族元素 c.Ⅶ族元素 d.过渡元素
(2)CrO42和Cr2O72在溶液中可相互转化。室温下,初始浓度为1.0 mol·L1的Na2CrO4溶液中c(Cr2O72)随c(H+)的变化如图所示。
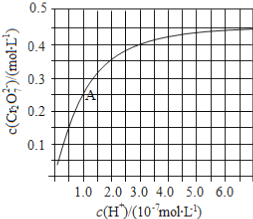
①用离子方程式表示Na2CrO4溶液中的转化反应____________。
②由图可知,溶液酸性增大,CrO42的平衡转化率__________(填“增大“减小”或“不变”)。根据A点数据,计算出该转化反应的平衡常数为__________。
③升高温度,溶液中CrO42的平衡转化率减小,则该反应的ΔH_________0(填“>”“<”或“=”)。
(3)欲降低废水中重金属元素铬的毒性,可将Cr2O72-转化为Cr(OH)3沉淀除去.已知:
氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
Fe2+ | 7.0 | 9.0 |
Fe3+ | 1.9 | 3.2 |
Cr3+ | 6.0 | 8.0 |
某含铬废水处理的主要流程如图所示:
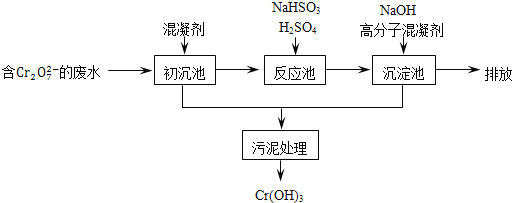
①初沉池中加入的混凝剂是K2SO4﹒Al2(SO4)3﹒24H2O,其作用为__________(用离子方程式表示).
②反应池中用NaHSO3将酸性废液中的Cr2O72-还原成Cr3+,该反应的离子方程式为________.根据“沉淀法”和“中和法”的原理,向沉淀池中加入NaOH溶液,此过程中发生主要反应的离子的先后顺序是____________.证明Cr3+沉淀完全的方法是__________.
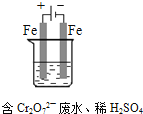
(4)工业可用电解法来处理含 Cr2O72-废水.实验室利用如图模拟处理含Cr2O72-的废水,阳极反应式是Fe-2e-═Fe2+,阴极反应式是2H++2e-═H2↑.Fe2+与酸性溶液中的Cr2O72-反应的离子方程式是__________,得到的金属阳离子在阴极区可沉淀完全,用电解法处理该溶液中0.01mol Cr2O72-时,至少得到沉淀的质量是__________ g.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂钒氧化物二次电池的成本较低,对环境无污染,能量密度远远高于其他电池,电池总反应为V2O5+xLi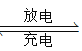 LixV2O5。下列说法合理的是
LixV2O5。下列说法合理的是
A. 电池在放电时,Li+向负极移动
B. 锂在放电时作正极,充电时作阳极
C. 该电池充电时阳极的反应为LixV2O5-xe-=V2O5+xLi+
D. V2O5只是锂发生反应的载体,不参与电池反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可能引起实验结果偏小的操作是( )
A.测定 NaOH 溶液浓度:锥形瓶水洗后没有润洗
B.硫酸铜晶体中结晶水含量测定:加热时晶体溅出
C.常温常压下 1 摩尔H2 体积测定:反应的镁条有氧化膜
D.配制 0.1mol·L-1NaOH 溶液:俯视凹液面最低处与容量瓶刻度线相切
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com