
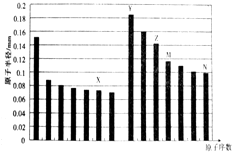
| A. | Y、Z两种元素的离子半径相比前者较大 | |
| B. | M、N两种元素的气态氢化物的稳定性相比后者较强 | |
| C. | M的氧化物既能碱反应又能和氢氟酸反应,但是该氧化物是典型的酸性氧化物 | |
| D. | 工业上常用的电解Y和N形成的化合物的水溶液制取Y的单质 |
分析 图中元素分别为第二周期和第三周期元素的原子半径的变化,根据原子序数关系可知X为O元素,Y为Na元素,Z为Al元素,M为Si元素,N为Cl元素,结合对应物质的性质解答该题.
解答 解:图中元素分别为第二周期和第三周期元素的原子半径的变化,根据原子序数关系可知X为O元素,Y为Na元素,Z为Al元素,M为Si元素,N为Cl元素,
A.Y为Na元素,Z为Al元素,离子半径Na+>Al3+,故A正确;
B.非金属性Si<Cl,元素的非金属性越强,对应的氢化物越稳定,即M、N两种元素的气态氢化物的稳定性相比后者较强,故B正确;
C.Si的氧化物与碱反应,与酸反应只与HF反应,与其它的酸不反应,SiO2是酸性氧化物,故C正确;
D.工业制备Na,常用电解熔融NaCl的方法冶炼,电解氯化钠溶液得不到单质钠,故D错误.
故选D.
点评 本题考查原子结构与元素周期律,题目难度中等,推断元素是解题的关键,要抓住“短周期主族元素”,根据原子半径变化规律结合原子序数进行推断.


科目:高中化学 来源: 题型:解答题
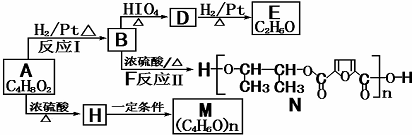
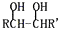 $→_{△}^{HIO_{4}}$RCHO+OHCR′
$→_{△}^{HIO_{4}}$RCHO+OHCR′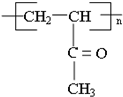
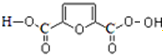 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
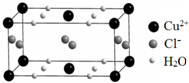 将过量的氨水加到硫酸铜溶液中,溶液最终变成深蓝色,继续加入乙醇,析出深蓝色的晶体[Cu(NH3)4]SO4•H2O.
将过量的氨水加到硫酸铜溶液中,溶液最终变成深蓝色,继续加入乙醇,析出深蓝色的晶体[Cu(NH3)4]SO4•H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 电解原理在化学工业中有着广泛的应用.现将某同学设计的原电池通过
电解原理在化学工业中有着广泛的应用.现将某同学设计的原电池通过查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 误将洁厕灵与消毒液混合:2H++Cl-+ClO-═Cl2↑+H2O | |
| B. | 向100mL0.1mol/L FeBr2溶液中通入0.0125mol Cl2:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- | |
| C. | 高锰酸钾酸性溶液吸收二氧化硫:SO2+MnO4-+4H+═SO42-+Mn2++2H2O | |
| D. | 向明矾溶液中加入过量的氢氧化钡溶液:Al3++SO42-+Ba2++4OH-═BaSO4↓+[Al(OH)4]- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向 NaOH 溶液中通入过量 C02:20H-+CO2=CO32-+H2O | |
| B. | 电解氯化镁溶液:2C1-+2H20$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+20H- | |
| C. | 向 H202 溶液中加入 Mn02:2H202+4H++Mn02=02↑+Mn2++4H20 | |
| D. | 向KAl(SO2)2溶液中滴加Ba(OH)2溶液至SO42-沉淀完全:Al3++2SO42-+2Ba2++40H-=A1O2-+2BaS04+2H20 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu+HNO3(稀)→Cu(NO3)2 | |
| B. | Cu+HNO3(浓)→Cu(NO3)2 | |
| C. | Cu$→_{加热}^{浓硫酸}$CuSO4$\stackrel{HNO_{3}}{→}$Cu(NO3)2 | |
| D. | Cu$→_{加热}^{空气}$CuO$\stackrel{HNO_{3}}{→}$Cu(NO3)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可能有O2 | B. | 肯定没有Cl2、NO2 | C. | 肯定有NH3 | D. | 肯定有NO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com