
 电解原理在化学工业中有着广泛的应用.现将某同学设计的原电池通过
电解原理在化学工业中有着广泛的应用.现将某同学设计的原电池通过分析 (1)电解硫酸铜溶液时,阳极上氢氧根离子放电,阴极上铜离子放电;
(2)先根据离子放电顺序及溶液中溶质的物质的量确定阳极上析出的物质,再根据转移电子守恒计算阴极上析出的物质,根据溶液中氢离子浓度计算溶液的pH.
解答 解:(1)电解硫酸铜溶液时,阳极上氢氧根离子放电,阴极上铜离子放电,所以电池反应式为
2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+2H2SO4,故答案为:2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+2H2SO4;
(2)电解混合溶液时,阳极上氯离子放电,电极反应式为2Cl--2e-=Cl2↑,0.04mol氯离子只能生成0.02mol氯气,即448mL氯气,转移0.04mol电子,共生成672mL气体,说明还有224mL气体来自于水的电解,根据4OH--4e-=2H2O+O2↑知,生成224mL氧气又转移0.04mol电子,所以电解过程中一共转移0.08mol电子,阴极上先铜离子放电,电极反应式为:Cu2++2e-=Cu,现有0.04mol铜离子恰好完全电解析出,由此可得整个过程中消耗了0.04mol氢氧根离子,根据水的电离方程式知,溶液中氢离子浓度为0.04mol,则氢离子浓度为0.1mol/L,则溶液的pH=1,
故答案为:1.
点评 本题考查电解池的工作原理以及计算,溶液pH的计算,根据溶液中的溶质计算阳极上的产物,再结合转移电子相等进行解答即可,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 温度和压强一定时,对于可逆反应:2NO2(g)?N2O4(g),混合气体的密度不再改变,则反应达到平衡状态 | |
| B. | 已知:H2(g)+F2(g)═2HF(g)△H=-270 kJ•mol-1,则1 mol氢气与1 mol氟气反应生成2 mol液态氟化氢放出的热量小于270 kJ | |
| C. | 500℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g)═2NH3(g)△H=-38.6 kJ•mol-1 | |
| D. | 已知:C(s,金刚石)═C(s,石墨)△H=-1.5 kJ•mol-1,说明金刚石更稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A是一种重要的化工原料,用来衡量一个国家的石油化工发展水平,相同条件下存在如下转化关系(部分反应物、反应条件和产物已省略),其中E为具有果香气味的物质,F是高聚物.
A是一种重要的化工原料,用来衡量一个国家的石油化工发展水平,相同条件下存在如下转化关系(部分反应物、反应条件和产物已省略),其中E为具有果香气味的物质,F是高聚物.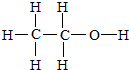 ;写出其官能团的电子式
;写出其官能团的电子式 ,1个该官能团含有9个电子,氢氧根与其组成元素相同,电子式为
,1个该官能团含有9个电子,氢氧根与其组成元素相同,电子式为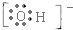 ,含有有10个电子;高聚物F是常用的塑料之一,它的链节可表示为-CH2CH2-.
,含有有10个电子;高聚物F是常用的塑料之一,它的链节可表示为-CH2CH2-.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实 验 事 实 | 结 论 | |
| ① | Cl2的水溶液可以导电 | Cl2是电解质 |
| ② | 将烧红的铁片插入水中生成氢气 | 还原性:Fe>H2 |
| ③ | 向久置空气的漂白粉中加盐酸有CO2气体产生 | 酸性:H2CO3>HClO |
| ④ | 常温下白磷可自燃而氮气须在放电时才与氧气反应 | 非金属性:P>N |
| ⑤ | 某无色溶液中加入氢氧化钠浓溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝 | 该溶液一定含有NH4+ |
| A. | ③④⑤ | B. | ②③⑤ | C. | ①②③ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
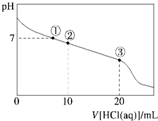 常温下,向20.00mL 0.100mol•L-1 CH3COONa溶液中逐滴加入0.100 0mol•L-1盐酸,溶液的pH与所加盐酸体积的关系如图所示(不考虑挥发).下列说法正确的( )
常温下,向20.00mL 0.100mol•L-1 CH3COONa溶液中逐滴加入0.100 0mol•L-1盐酸,溶液的pH与所加盐酸体积的关系如图所示(不考虑挥发).下列说法正确的( )| A. | 点①所示溶液中:c(CH3COOH)=c(Cl-)>c(OH-)=c(H+) | |
| B. | 点②所示溶液中:c(Na+)>c(Cl-)>c(CH3COO-)>c(CH3COOH) | |
| C. | 点③所示溶液中:c(CH3COOH)>c(Na+)>c(H+)>c(CH3COO-) | |
| D. | 整个过程中可能出现:c(H+)+c(Na+)═c(CH3COOH)+c(CH3COO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原生铜的硫化物具有还原性 | |
| B. | 常温时ZnS、PbS、CuS都难溶于水,CuSO4可溶于水 | |
| C. | 铜蓝的形成过程是:ZnS(S)+Cu2+?CuS(S)+Zn2+ | |
| D. | 硝酸型酸雨不利于铜蓝的形成:CuS+2H+═Cu2++H2S↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
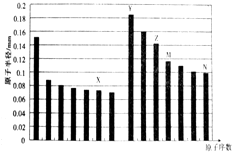
| A. | Y、Z两种元素的离子半径相比前者较大 | |
| B. | M、N两种元素的气态氢化物的稳定性相比后者较强 | |
| C. | M的氧化物既能碱反应又能和氢氟酸反应,但是该氧化物是典型的酸性氧化物 | |
| D. | 工业上常用的电解Y和N形成的化合物的水溶液制取Y的单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应后溶液中不存在任何沉淀,所以反应前后[Cu(H2O)4]2+的数目不变 | |
| B. | 沉淀溶解后,将生成深蓝色的配合离子[Cu(NH3)4]2+ | |
| C. | 向反应后的深蓝色溶液中加入乙醇,不会产生任何现象 | |
| D. | 在[Cu(NH3)4]2+离子中,Cu2+给出孤对电子,NH3提供空轨道 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
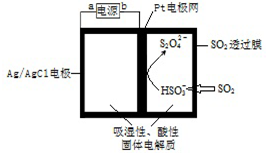
| A. | 阴极发生氧化反应 | |
| B. | 当电路中电子转移为5×10-5mol时,进入传感器的SO2为 1.12 mL | |
| C. | 正极反应式 Ag-e-=Ag+ | |
| D. | b为电源的负极 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com