
【题目】乙烯的产量可以用来衡量一个国家的石油化工发展水平,请回答:
(1)乙烯的结构简式是__。
(2)写出乙烯在一定条件下生成聚乙烯塑料的化学方程式为___。
(3)可以用来除去乙烷中混有的乙烯的试剂是__(填序号![]()
①水 ②氢气 ③溴水 ④酸性高锰酸钾溶液
(4)在一定条件下,乙烯能与水反应生成有机物A,A的结构简式是__,其反应类型是__反应![]() 填“取代”或“加成”
填“取代”或“加成”![]() 。
。
(5)下列化学反应原理相同的是__![]() 填序号
填序号![]() 。
。
①乙烯使溴的四氯化碳溶液和酸性高锰酸钾溶液褪色
②SO2使溴水和酸性高锰酸钾溶液褪色
③SO2使品红溶液和滴有酚酞的NaOH溶液褪色
【答案】CH2=CH2 nCH2=CH2![]()
![]() ③ CH3CH2OH 加成 ②
③ CH3CH2OH 加成 ②
【解析】
(1)乙烯中含有碳碳双键,结构简式是CH2=CH2。
(2)乙烯在一定条件下发生加成反应生成聚乙烯塑料的化学方程式为nCH2=CH2![]()
![]() 。
。
(3)乙烷和乙烯都不溶于水,不能用水除乙烯;乙烯在一定条件下能与氢气发生加成反应,但是不好控制氢气的用量,不能用来除杂;乙烯能和溴水发生加成反应,乙烷不能,故能用来除去乙烷中的乙烯;乙烯被酸性高锰酸钾溶液氧化生成二氧化碳,引入新的杂质,不能用来除去乙烷中混有的乙烯;故选③溴水。
(4)在一定条件下,乙烯能与水发生加成反应生成有机物A,A为乙醇,结构简式是CH3CH2OH。
(5)①乙烯使溴的四氯化碳溶液褪色是加成反应,使酸性高锰酸钾溶液褪色是氧化反应,原理不相同;②SO2使溴水和酸性高锰酸钾溶液褪色都为氧化还原反应,原理相同;③SO2使品红溶液褪色是二氧化硫的漂白性,使滴有酚酞的NaOH溶液褪色是利用二氧化硫是酸性氧化物的性质,原理不相同;故原理相同的为②。


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
【题目】常温下,向浓度均为 0.1mol·L1、体积均为100mL的两种一元酸HA、HB的溶液中,分别加入固体NaOH,溶液中的lg![]() 随加入 NaOH 的物质的量的变化如图所示。下列说法正确的是
随加入 NaOH 的物质的量的变化如图所示。下列说法正确的是

A.由水电离出的 c(H+)的顺序为:c﹥a﹥b
B.b 点时酸碱恰好完全中和
C.c 点溶液中:c(B)﹥c(HB)
D.常温下电离常数:HA﹤HB
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美国康乃尔大学的魏考克斯(C·wilcox)所合成的一种有机分子,就像一尊释迦牟尼佛,因而称为释迦牟尼分子(所有原子在同一平面上)。有关该有机分子的说法不正确的是( )
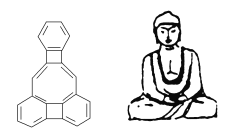
A. 属于芳香烃
B. 不属于苯的同系物
C. 分子中含有22个碳原子
D. 它和分子式为C22H12的有机物可能互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化工原料异丁烯(C4H8)可由异丁烷(C4H10)直接催化脱氢制备:C4H10(g) ![]() C4H8(g) + H2(g)ΔH=+139 kJ/mol
C4H8(g) + H2(g)ΔH=+139 kJ/mol
(1)该反应的化学平衡常数的表达式为_________________。
(2)一定条件下,以异丁烷为原料生产异丁烯。温度、压强改变对异丁烷平衡转化率的
影响如下图所示。
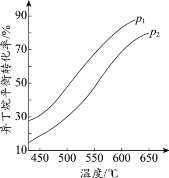
①判断p1、p2的大小关系:p1_________________(填“>”或“<”)p2,理由是_________________。
②若异丁烷的平衡转化率为40%,则平衡混合气中异丁烯的物质的量分数最多为______%(保留小数点后1位)。
(3)目前,异丁烷催化脱氢制备异丁烯的研究热点是催化活性组分以及载体的选择。下表是以V-Fe-K-O为催化活性物质,反应时间相同时,测得的不同温度、不同载体条件下的数据。
温度/℃ | 570 | 580 | 590 | 600 | 610 | |
以γ-Al2O3为载体 | 异丁烷转化率/% | 36.41 | 36.49 | 38.42 | 39.23 | 42.48 |
异丁烯收率/% | 26.17 | 27.11 | 27.51 | 26.56 | 26.22 | |
以TiO2为载体 | 异丁烷转化率/% | 30.23 | 30.87 | 32.23 | 33.63 | 33.92 |
异丁烯收率/% | 25.88 | 27.39 | 28.23 | 28.81 | 29.30 | |
说明:收率=(生产目标产物的原料量/原料的进料量)×100%
①由上表数据,可以得到的结论是____________(填字母序号)。
a.载体会影响催化剂的活性
b. 载体会影响催化剂的选择性
c.载体会影响化学平衡常数
②分析以γ-Al2O3为载体时异丁烯收率随温度变化的可能原因:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式或说法正确的是
A. 同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的△H不同
B. 已知H2(g)+F2(g)=2HF(g)△H=-270kJ·mol-1,则1molH2与1molF2反应生成2mol液态氟化氢时放热大于270kJ
C. 甲烷的标准燃烧热为△H=-890.3kJ·mol-1,则其燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJ·mol-1
D. 500℃、30MPa下,将0.5molN2和1.5molH2置于密闭容器中充分反应生成NH3,放热19.3kJ,其热化学方程式为N2(g)+3H2(g)![]() 2NH3(g)△H=-38.6kJ·mol-1
2NH3(g)△H=-38.6kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各图示与对应的描述相符合的是

A. 图甲表示分别稀释pH=11的NaOH溶液和氨水时溶液pH的变化,图中b>a=100
B. 图乙表示某化学平衡的移动,在t1时改变的条件一定是加入催化剂
C. 图丙表示平衡2NO2(g)![]() N2O4(g)在t1时迅速将体积缩小后c(N2O4)的变化
N2O4(g)在t1时迅速将体积缩小后c(N2O4)的变化
D. 图丁表示CH3COOH溶液中通入NH3至过量的过程中溶液导电性的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】4-AFMF是一种探测物质的荧光素,其结构简式如下图。下列有关该物质的说法正确的是

A. 分子中三个苯环处于同一平面
B. 1 mol 4-AFMF 最多可与2molNaOH 反应
C. 在酸性条件下水解,水解产物只有1种
D. 能与溴水、FeCl3溶液及稀硫酸发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是化学实验室及化工生产中的重要物质,应用广泛。
(1)已知25℃时:N2(g)+O2(g)![]() 2NO(g)△H=+183kJ/mol,2H2(g)+O2(g)═2H2O(l)△H=﹣571.6 kJ/mol,4NH3(g)+5O2(g)═4NO(g)+6H2O(l)△H=﹣1164.4kJ/mol,则N2(g)+3H2(g)
2NO(g)△H=+183kJ/mol,2H2(g)+O2(g)═2H2O(l)△H=﹣571.6 kJ/mol,4NH3(g)+5O2(g)═4NO(g)+6H2O(l)△H=﹣1164.4kJ/mol,则N2(g)+3H2(g)![]() 2NH3(g)△H=____________ ;
2NH3(g)△H=____________ ;
(2)在恒温恒容密闭容器中进行合成氨反应,起始投料时各物质浓度如下表:
N2 | H2 | NH3 | |
投料Ⅰ | 1.0mol/L | 3.0mol/L | 0 |
投料Ⅱ | 1.0mol/L | 2mol/L | 1.0mol/L |
①按投料Ⅰ进行反应,测得达到化学平衡时化学平衡常数为0.1,则该温度下合成氨反应的平衡常数表达式为_____;
②按投料Ⅱ进行反应,起始时反应进行的方向为_____________(填“正向”或“逆向”);
③若该反应在一恒温、恒容密闭容器内进行,判断反应达到平衡状态的标志是____;
a.NH3是N2浓度的2倍b.容器中气体的压强不再改变c.2v(NH3)正=v(N2)逆d.容器中混合气体的密度不再改变e.容器中N2、H2、NH3物质的量之比为1:3:2f.混合气体平均相对分子质量保持不变
④若升高温度,则合成氨反应的化学平衡常数_______(填“变大”、“变小”或“不变”);
⑤L(L1、L2)、X可分别代表压强或温度。如图表示L一定时,合成氨反应中H2(g)的平衡转化率随X的变化关系;
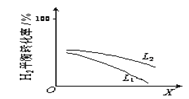
ⅰ)X代表的物理量是_________________;
ⅱ)判断L1、L2的大小关系,L1__________L2.(填“>”“<”或“=”)
⑶电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意如图:
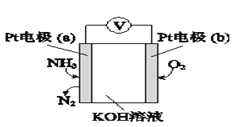
①电极b上发生的是____________反应(填“氧化”或“还原”)。
②写出电极a的电极反应式:________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】储氢纳米碳管的研究成功体现了科技的进步,但用电孤法合成的碳纳米管常伴有大量的杂质-碳纳米颗粒,这种碳纳米颗粒可用氧化气化法提纯。反应化学方程式为:3C+2K2Cr2O7 +8H2SO4 = 3CO2↑+ 2K2SO4+2Cr2(SO4)3 +8 H2O
(1)上述反应中氧化剂是___________(填化学式), 被氧化的元素是_________(填元素符号)。
(2)H2SO4 在上述反应中表现出来的性质是____________(填选项编号)
A.氧化性 B.氧化性和酸性 C.还原性和酸性 D.酸性
(3)若反应中电子转移了0.8mol,则产生的气体在标准状况下的体积为______________L。
(4)请用双线桥法标出电子转移的方向和数目___________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com