
����Ŀ�����ǻ�ѧʵ���Ҽ����������е���Ҫ���ʣ�Ӧ�ù㷺��
(1)��֪25��ʱ��N2��g��+O2��g��![]() 2NO��g����H=+183kJ/mol��2H2��g��+O2��g���T2H2O��l����H=��571.6 kJ/mol��4NH3��g��+5O2��g���T4NO��g��+6H2O��l����H=��1164.4kJ/mol����N2��g��+3H2��g��
2NO��g����H=+183kJ/mol��2H2��g��+O2��g���T2H2O��l����H=��571.6 kJ/mol��4NH3��g��+5O2��g���T4NO��g��+6H2O��l����H=��1164.4kJ/mol����N2��g��+3H2��g��![]() 2NH3��g����H=____________ ��
2NH3��g����H=____________ ��
(2)�ں��º����ܱ������н��кϳɰ���Ӧ����ʼͶ��ʱ������Ũ�����±���
N2 | H2 | NH3 | |
Ͷ�Ϣ� | 1.0mol/L | 3.0mol/L | 0 |
Ͷ�Ϣ� | 1.0mol/L | 2mol/L | 1.0mol/L |
�ٰ�Ͷ�Ϣ���з�Ӧ����ôﵽ��ѧƽ��ʱ��ѧƽ�ⳣ��Ϊ0.1������¶��ºϳɰ���Ӧ��ƽ�ⳣ������ʽΪ_____��
�ڰ�Ͷ�Ϣ���з�Ӧ����ʼʱ��Ӧ���еķ���Ϊ_____________�������������
�����÷�Ӧ��һ���¡������ܱ������ڽ��У��жϷ�Ӧ�ﵽƽ��״̬�ı�־��____��
a��NH3��N2Ũ�ȵ�2��b�������������ѹǿ���ٸı�c��2v��NH3����=v��N2����d�������л��������ܶȲ��ٸı�e��������N2��H2��NH3���ʵ���֮��Ϊ1:3:2f���������ƽ����Է����������ֲ���
���������¶ȣ���ϳɰ���Ӧ�Ļ�ѧƽ�ⳣ��_______����������С�����䡱����
��L��L1��L2����X�ɷֱ����ѹǿ���¶ȡ���ͼ��ʾLһ��ʱ���ϳɰ���Ӧ��H2��g����ƽ��ת������X�ı仯��ϵ��
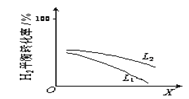
����X��������������_________________��
�����ж�L1��L2�Ĵ�С��ϵ��L1__________L2�����������������=����
�ǵ绯ѧ���������������ڼ�����NH3�ĺ������乤��ԭ��ʾ����ͼ��
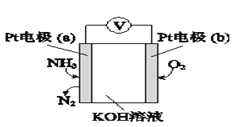
�ٵ缫b�Ϸ�������____________��Ӧ�����������ԭ������
��д���缫a�ĵ缫��Ӧʽ��________________________��
���𰸡���92.2kJ/mol ![]() ���� bf ��С �¶� �� ��ԭ 2NH3��6e��+6OH��=N2+6H2O
���� bf ��С �¶� �� ��ԭ 2NH3��6e��+6OH��=N2+6H2O
��������
(1)���ø�˹���ɶ��Ȼ�ѧ����ʽֱ�ӽ��мӼ���
(2)������ѧƽ�ⳣ���Ķ����д�������ʽ��
������Ũ�����뻯ѧƽ�ⳣ������ֵ��С�Ƚ����жϷ�Ӧ���еķ���
���жϷ�Ӧ��ƽ��״̬��Ҫ�������жϣ�һ�������淴Ӧ������ȣ����DZ������䣻
�ܻ�ѧƽ�ⳣ�����¶ȵĺ�����������ȣ��¶����ߣ�ƽ�ⳣ����С��
�ݽ��ۺϳɰ���Ӧ���ص㣬�����ͼ���з�����
�ǴӼ�̬�仯���������缫aΪ����������������Ӧ���缫bΪ������������ԭ��Ӧ��ע��������Ǽ��Խ��ʡ�
(1) ��֪25��ʱ��N2��g��+O2��g��![]() 2NO��g����H=+183kJ/mol�٣�
2NO��g����H=+183kJ/mol�٣�
2H2��g��+O2��g���T2H2O��l����H=��571.6 kJ/mol�ڣ�
4NH3��g��+5O2��g���T4NO��g��+6H2O��l����H=��1164.4kJ/mol�ۣ�
���ݸ�˹���ɣ�����+����![]() -
-![]() ���۵ã�N2��g��+3H2��g��
���۵ã�N2��g��+3H2��g��![]() 2NH3��g��
2NH3��g��
��H=+183-571.6��![]() +
+![]() ��1164.4=-92.2kJ/mol��
��1164.4=-92.2kJ/mol��
(2)�ٺϳɰ���ӦΪ�� N2��g��+3H2��g��![]() 2NH3��g�����÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽΪ��
2NH3��g�����÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽΪ��![]() ��
��
��Ͷ��II��Ӧ�Ļ�ѧƽ�ⳣ����Ϊ0.1����Ӧ��Ũ����![]() >0.1�����Ի�ѧ��Ӧ���淴Ӧ������У�
>0.1�����Ի�ѧ��Ӧ���淴Ӧ������У�
�ۻ�ѧƽ�⽨��ʱ�������淴Ӧ������ȣ��������䡣
a�����ƽ��ʱŨ���Dz����������ȣ�Ҳ���dzɱ�����
b����ȷ������һ�����������������С�ķ�Ӧ����Ӧ������ѹǿ��һ���������������䣬˵���÷�Ӧ�ﵽƽ�⣻
c�����2Ӧ��Ϊ![]() ��
��
d������ܶ�ʼ�ղ��䣻
e�����ƽ��ʱ��Ũ�Ȳ��䣬������ȣ�Ҳ���dzɱ�����
f��ȷ����Ӧ�������ʱ��ƽ����Է������������������䣬˵���÷�Ӧ��ƽ�⣻
�ܸ÷�Ӧ������ȣ��¶����ߣ�ƽ�����ƣ���ѧƽ�ⳣ��Ҫ��С��
�ݺϳɰ���Ӧ��һ�������������������С�ķ��ȷ�Ӧ�����£���Ӧ��ת���ʽ��ͣ���ѹ����Ӧ��ת������ߡ���ͼ��������X������H2��ƽ��ת���ʼ�С����ȻX���������¶ȡ���ͼ��L��������ѹǿ��ѹǿԽ��H2ת����Խ�ߣ�����L2��Ӧ��ѹǿ�ߡ�
��3���ٵ缫b����Ԫ����0�۱�Ϊ-2�ۣ���̬���ͣ������˻�ԭ��Ӧ��
�ڵ缫a��NH3ʧ���ӣ����N2�������Ľ���Ϊǿ���ԣ��缫��ӦʽΪ��2NH3��6e��+6OH��=N2+6H2O��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������þ�������Ʊ�������Ӳ���ߵ��ȡ����µĵ����ʵ����������װ����ȡ����þ����֪��Mg+2NH3![]() Mg(NH2)2+H2��Mg3N2��һ��dz��ɫ��ĩ����ˮ�⡣����˵������ȷ����
Mg(NH2)2+H2��Mg3N2��һ��dz��ɫ��ĩ����ˮ�⡣����˵������ȷ����
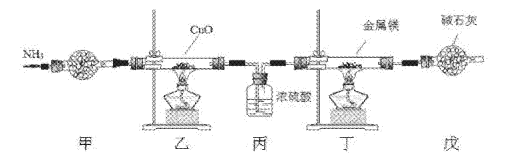
A. ʵ�鿪ʼʱӦ�ȵ�ȼ�Ҵ��ƾ��ƣ��ٵ�ȼ�����ƾ���
B. װ���ҵ�Ŀ�����Ʊ�N2
C. װ�ñ���װ������ԶԵ�
D. ȡװ�ö����ù���������������������ˮ���ɼ����Ƿ���Mg3N2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ϩ�IJ���������������һ�����ҵ�ʯ�ͻ�����չˮƽ����ش�
��1����ϩ�Ľṹ��ʽ��__��
��2��д����ϩ��һ�����������ɾ���ϩ���ϵĻ�ѧ����ʽΪ___��
��3������������ȥ�����л��е���ϩ���Լ���__(�����![]()
��ˮ ������ ����ˮ �����Ը��������Һ
��4����һ�������£���ϩ����ˮ��Ӧ�����л���A��A�Ľṹ��ʽ��__���䷴Ӧ������__��Ӧ![]() ����ȡ���������ӳ���
����ȡ���������ӳ���![]() ��
��
��5�����л�ѧ��Ӧԭ����ͬ����__![]() �����
�����![]() ��
��
����ϩʹ������Ȼ�̼��Һ�����Ը��������Һ��ɫ
��SO2ʹ��ˮ�����Ը��������Һ��ɫ
��SO2ʹƷ����Һ�͵��з�̪��NaOH��Һ��ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��A���л���ѧ��ҵ�Ļ���ԭ�ϣ������������������һ�����ҵ�ʯ�ͻ�����չˮƽ��A����һ��ֲ���������ڼ���A�ɷ�����ͼ��ʾ��һϵ�л�ѧ��Ӧ��
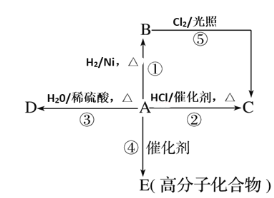
������ͼ�ش��������⣺
(1)д��B��D�Ľṹ��ʽ��B_______��D________��
(2)д���ڢ�������Ӧ�Ļ�ѧ����ʽ����ע����Ӧ���ͣ�
��_____________����Ӧ����____________����
��_________����Ӧ����____________����
(3)�����ͬ���칹���У�����ͬ�����·е���͵���________��д�ṹ��ʽ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʯ�Ͳ�Ʒ�к���H2S��COS��CH3SH�ȶ����л���ʯ�ͻ����������������������ش��������⣺
(1)��֪�Ȼ�ѧ����ʽ����2H2S(g)+SO2(g)=3S(s)+2H2O(l) ��H1=-362 kJ��mol-1
��2H2S(g)+3O2(g)=2SO2(g)+2H2O(l) ��H2=-1172 kJ��mol-1
��H2S�����������Ӧ���ɹ�̬���Һ̬ˮ���Ȼ�ѧ����ʽΪ__________________��
(2)������K2CO3��Һ����H2S����ԭ��ΪK2CO3+H2S=KHS+KHCO3���÷�Ӧ��ƽ�ⳣ��Ϊ_______��(��֪H2CO3 ��Ka1=4.2��10-7��Ka2=5.6��10-11��H2S��Ka1=5.6��10-8��Ka2=1.2��10-15)
(3)��ǿ����Һ����H2O2 �ɽ�COS����Ϊ���ᣬ��һԭ��������COS �����÷�Ӧ�Ļ�ѧ����ʽΪ_______��
(4)COS��ˮ�ⷴӦΪCOS(g)+H2O(g)![]() CO2(g)+H2S(g) ��H<0��ij�¶�ʱ���û�����-Al2O3���������ں����ܱ�������COS(g)��ƽ��ת�����治ͬͶ�ϱ�[n(H2O)/n(COS)]��ת����ϵ��ͼ1��ʾ������������ͬʱ���ı䷴Ӧ�¶ȣ����һ��ʱ����COS��ˮ��ת������ͼ2��ʾ��
CO2(g)+H2S(g) ��H<0��ij�¶�ʱ���û�����-Al2O3���������ں����ܱ�������COS(g)��ƽ��ת�����治ͬͶ�ϱ�[n(H2O)/n(COS)]��ת����ϵ��ͼ1��ʾ������������ͬʱ���ı䷴Ӧ�¶ȣ����һ��ʱ����COS��ˮ��ת������ͼ2��ʾ��
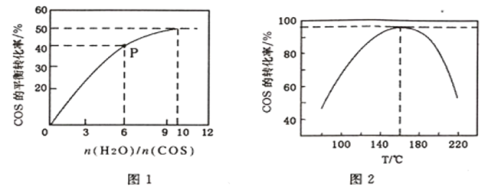
�ٸ÷�Ӧ���������Ϊ:Ͷ�ϱ�[n(H2O)/n(COS)]__________���¶�__________��
��P���Ӧ��ƽ�ⳣ��Ϊ_____________ ��(����С�����2 λ)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾװ�ã�������ָ�뷢��ƫת��ͬʱA����֣�B����ϸ��CΪ�������Һ����A��B��CӦ�����и����е�(����)
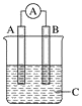
A. A��Zn��B��Cu��CΪϡ����
B. A��Cu��B��Zn��CΪϡ����
C. A��Fe��B��Ag��CΪϡAgNO3��Һ
D. A��Ag��B��Fe��CΪϡAgNO3��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ж�����Ԫ�ص�����(��֪Be��ԭ�Ӱ뾶Ϊ0.089 nm)��
�� | �� | �� | �� | �� | �� | �� | �� | |
ԭ�Ӱ뾶(nm) | 0.074 | 0.160 | 0.152 | 0.110 | 0.099 | 0.186 | 0.075 | 0.082 |
��� �����ϼ� | ��2 | ��1 | ��5 | ��7 | ��1 | ��5 | ��3 | |
��� �����ϼ� | ��2 | ��3 | ��1 | ��3 |
(1)����Ԫ�������ڱ��е�λ����______________________________��������Ԫ�ش���ͬһ�������__________________________________�� (��Ԫ�ط��ű�ʾ)
(2)Ԫ�����������γ����ֻ����д�������ֻ�����ĵ���ʽ_______________________��________________________��
(3)�ܺ͢�Ԫ������������Ӧ��ˮ�������Խ�ǿ����________(�����ʻ�ѧʽ��ʾ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������ȷ����
A. 2��3��3��4���ļ������һ�ȴ�����3��
B. ����ʽΪC3H2Cl6���л����ͬ���칹��(�����������칹)����4��
C. �����������Ļ�������ڹ��������·�Ӧ���ɵ��л����������ͬ���칹��
D. �ṹ��ʽΪH3C![]() CH3���л�����ڷ����廯�����ͬ���칹����2��
CH3���л�����ڷ����廯�����ͬ���칹����2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2016��IUPAC����117��Ԫ��ΪTs����������![]() ����ti��n����Ts��ԭ�Ӻ���������������7������˵������ȷ����
����ti��n����Ts��ԭ�Ӻ���������������7������˵������ȷ����
A.Ts�ǵ������ڵڢ�A��Ԫ��
B.Ts��ͬλ��ԭ�Ӿ�����ͬ�ĵ�����
C.Ts��ͬ��Ԫ���зǽ���������
D.������Ϊ176��Ts���ط�����![]()
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com