
【题目】某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的一系列化学反应。
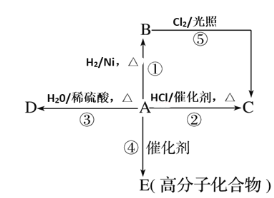
根据如图回答下列问题:
(1)写出B、D的结构简式:B_______;D________。
(2)写出②⑤两步反应的化学方程式,并注明反应类型:
②_____________(反应类型____________)。
⑤_________(反应类型____________)。
(3)戊烷的同分异构体中,在相同条件下沸点最低的是________(写结构简式)。
【答案】CH3CH3 CH3CH2OH CH2=CH2+HCl![]() CH3CH2Cl 加成反应 CH3CH3+Cl2
CH3CH2Cl 加成反应 CH3CH3+Cl2![]() CH3CH2Cl+HCl 取代反应
CH3CH2Cl+HCl 取代反应 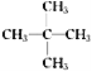
【解析】
A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,则A为乙烯CH2=CH2;A与H2发生加成反应生成的B为CH3CH3;B与Cl2在光照条件下发生取代反应,或乙烯与HCl发生加成反应,都生成C,C为CH3CH2Cl;A与H2O发生加成反应生成的D为CH3CH2OH;A发生加聚反应生成的E为聚乙烯![]() 。
。
(1)由以上分析知,B、D的结构简式:B为CH3CH3;D为CH3CH2OH;答案为:CH3CH3;CH3CH2OH;
(2)②为CH2=CH2与HCl加成生成CH3CH2Cl,化学方程式为CH2=CH2+HCl![]() CH3CH2Cl,反应类型为加成反应;答案为:CH2=CH2+HCl
CH3CH2Cl,反应类型为加成反应;答案为:CH2=CH2+HCl![]() CH3CH2Cl;加成反应;
CH3CH2Cl;加成反应;
⑤为CH3CH3与Cl2在光照条件下反应生成CH3CH2Cl和HCl,化学方程式为CH3CH3+Cl2![]() CH3CH2Cl+HCl ,反应类型为取代反应;答案为:CH3CH3+Cl2
CH3CH2Cl+HCl ,反应类型为取代反应;答案为:CH3CH3+Cl2![]() CH3CH2Cl+HCl;取代反应;
CH3CH2Cl+HCl;取代反应;
(3)戊烷的同分异构体有三种:CH3CH2CH2CH2CH3、![]() 、
、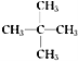 ,支链越多,分子间作用力越小,沸点越低,所以在相同条件下沸点最低的是
,支链越多,分子间作用力越小,沸点越低,所以在相同条件下沸点最低的是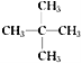 ;答案为:
;答案为: 。
。


 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案科目:高中化学 来源: 题型:
【题目】乙醇分子中的各种化学键如图所示,关于乙醇在各种反应中断裂键的说法不正确的是( )
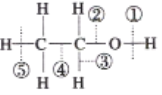
A. 和金属钠反应时键①断裂,发生置换反应
B. 在铜催化下与O2共热反应时断裂①和③,发生氧化反应
C. 与浓硫酸共热170°C下,主要断裂①和②,发生取代反应
D. 在空气中完全燃烧时断裂①②③④⑤,发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化工原料异丁烯(C4H8)可由异丁烷(C4H10)直接催化脱氢制备:C4H10(g) ![]() C4H8(g) + H2(g)ΔH=+139 kJ/mol
C4H8(g) + H2(g)ΔH=+139 kJ/mol
(1)该反应的化学平衡常数的表达式为_________________。
(2)一定条件下,以异丁烷为原料生产异丁烯。温度、压强改变对异丁烷平衡转化率的
影响如下图所示。
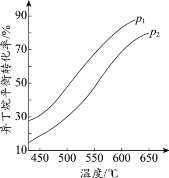
①判断p1、p2的大小关系:p1_________________(填“>”或“<”)p2,理由是_________________。
②若异丁烷的平衡转化率为40%,则平衡混合气中异丁烯的物质的量分数最多为______%(保留小数点后1位)。
(3)目前,异丁烷催化脱氢制备异丁烯的研究热点是催化活性组分以及载体的选择。下表是以V-Fe-K-O为催化活性物质,反应时间相同时,测得的不同温度、不同载体条件下的数据。
温度/℃ | 570 | 580 | 590 | 600 | 610 | |
以γ-Al2O3为载体 | 异丁烷转化率/% | 36.41 | 36.49 | 38.42 | 39.23 | 42.48 |
异丁烯收率/% | 26.17 | 27.11 | 27.51 | 26.56 | 26.22 | |
以TiO2为载体 | 异丁烷转化率/% | 30.23 | 30.87 | 32.23 | 33.63 | 33.92 |
异丁烯收率/% | 25.88 | 27.39 | 28.23 | 28.81 | 29.30 | |
说明:收率=(生产目标产物的原料量/原料的进料量)×100%
①由上表数据,可以得到的结论是____________(填字母序号)。
a.载体会影响催化剂的活性
b. 载体会影响催化剂的选择性
c.载体会影响化学平衡常数
②分析以γ-Al2O3为载体时异丁烯收率随温度变化的可能原因:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各图示与对应的描述相符合的是

A. 图甲表示分别稀释pH=11的NaOH溶液和氨水时溶液pH的变化,图中b>a=100
B. 图乙表示某化学平衡的移动,在t1时改变的条件一定是加入催化剂
C. 图丙表示平衡2NO2(g)![]() N2O4(g)在t1时迅速将体积缩小后c(N2O4)的变化
N2O4(g)在t1时迅速将体积缩小后c(N2O4)的变化
D. 图丁表示CH3COOH溶液中通入NH3至过量的过程中溶液导电性的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】4-AFMF是一种探测物质的荧光素,其结构简式如下图。下列有关该物质的说法正确的是

A. 分子中三个苯环处于同一平面
B. 1 mol 4-AFMF 最多可与2molNaOH 反应
C. 在酸性条件下水解,水解产物只有1种
D. 能与溴水、FeCl3溶液及稀硫酸发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20.00mL 0.200 0 mol/LNH4Cl溶液中逐滴加入0.2000 mol/LNaOH溶液时,溶液的pH与所加NaOH溶液体积的关系如下图所示(不考虑挥发)。下列说法正确的是
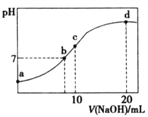
A. a点溶液中:c(H+)+c(NH3·H2O)=c(OH-)+c(NH4+)
B. b点溶液中:c(Cl-)=c(Na+)>c(H+)=c(OH-)
C. c点溶液中:c(NH3·H2O)+ c(NH4+)= c(Cl-)+ c(OH-)
D. d点溶液中:c(Cl-)> c(NH3·H2O)> c(OH-)> c(NH4+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是化学实验室及化工生产中的重要物质,应用广泛。
(1)已知25℃时:N2(g)+O2(g)![]() 2NO(g)△H=+183kJ/mol,2H2(g)+O2(g)═2H2O(l)△H=﹣571.6 kJ/mol,4NH3(g)+5O2(g)═4NO(g)+6H2O(l)△H=﹣1164.4kJ/mol,则N2(g)+3H2(g)
2NO(g)△H=+183kJ/mol,2H2(g)+O2(g)═2H2O(l)△H=﹣571.6 kJ/mol,4NH3(g)+5O2(g)═4NO(g)+6H2O(l)△H=﹣1164.4kJ/mol,则N2(g)+3H2(g)![]() 2NH3(g)△H=____________ ;
2NH3(g)△H=____________ ;
(2)在恒温恒容密闭容器中进行合成氨反应,起始投料时各物质浓度如下表:
N2 | H2 | NH3 | |
投料Ⅰ | 1.0mol/L | 3.0mol/L | 0 |
投料Ⅱ | 1.0mol/L | 2mol/L | 1.0mol/L |
①按投料Ⅰ进行反应,测得达到化学平衡时化学平衡常数为0.1,则该温度下合成氨反应的平衡常数表达式为_____;
②按投料Ⅱ进行反应,起始时反应进行的方向为_____________(填“正向”或“逆向”);
③若该反应在一恒温、恒容密闭容器内进行,判断反应达到平衡状态的标志是____;
a.NH3是N2浓度的2倍b.容器中气体的压强不再改变c.2v(NH3)正=v(N2)逆d.容器中混合气体的密度不再改变e.容器中N2、H2、NH3物质的量之比为1:3:2f.混合气体平均相对分子质量保持不变
④若升高温度,则合成氨反应的化学平衡常数_______(填“变大”、“变小”或“不变”);
⑤L(L1、L2)、X可分别代表压强或温度。如图表示L一定时,合成氨反应中H2(g)的平衡转化率随X的变化关系;
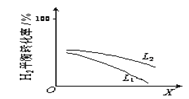
ⅰ)X代表的物理量是_________________;
ⅱ)判断L1、L2的大小关系,L1__________L2.(填“>”“<”或“=”)
⑶电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意如图:
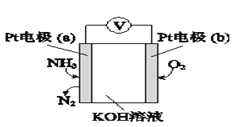
①电极b上发生的是____________反应(填“氧化”或“还原”)。
②写出电极a的电极反应式:________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)画出下列各微粒的结构示意图:L层电子数为K、M层电子数之和的原子形成的阴离子________;与Ne原子电子层结构相同的+1价阳离子________。
(2)写出下列物质或离子的电子式
N2 ________CO2 _________ OH- ____________NH![]() ___________
___________
(3)用电子式表示H2S和MgBr2的形成过程
H2S ________________________________
MgF2_______________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某100mL混合溶液中,H2SO4和HNO3的物质的量浓度分别是4.0mol/L和2.0mol/L,向该混合溶液中加入25.6g铜粉,加热,待充分反应后,静置,得到蓝色澄清溶液(假设反应后溶液体积不变)。下列说法中正确的是( )
A.产生的NO在标准状况下的体积是1.12L
B.反应后溶液中Cu2+的物质的量浓度为3.0mol/L
C.反应后溶液中H+的物质的量浓度为8.0mol/L
D.在反应后的溶液中加0.6molNaOH刚好使Cu2+完全沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com