
【题目】某温度时,AgCl(s)![]() Ag+(aq)+Cl-(aq)在水中的溶解平衡曲线如图。下列说法正确的是
Ag+(aq)+Cl-(aq)在水中的溶解平衡曲线如图。下列说法正确的是
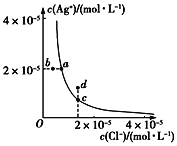
A. 加入AgNO3可以使溶液由c点变到d点
B. 加入固体NaCl,则AgCl的溶解度减小,Ksp也减小
C. d点有AgCl沉淀生成
D. a点对应的Ksp小于b点对应的Ksp
科目:高中化学 来源: 题型:
【题目】氢氰酸(HCN)是一种剧毒类弱酸,具有苦杏仁气味,将其加水不断稀释,下列各量始终保持增大的是
A. Ka(HCN) B. c(H+) C. c(CN-)/c(HCN) D. C(HCN)/ c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨是人类研究的重要课题,目前工业合成氨的原理为:N2(g) + 3H2(g) ![]() 2NH3(g) ΔH=-93.0kJ/mol
2NH3(g) ΔH=-93.0kJ/mol
(1)某温度下,在2 L密闭容器中发生上述反应,测得数据如下:
时间/h 物质的量/mol | 0 | 1 | 2 | 3 | 4 |
N2 | 2.0 | 1.83 | 1.7 | 1.6 | 1.6 |
H2 | 6.0 | 5.49 | 5.1 | 4.8 | 4.8 |
NH3 | 0 | 0.34 | 0.6 | 0.8 | 0.8 |
①0~2 h内,v(N2)=____________。
②平衡时,H2的转化率为______;
该温度下,反应2NH3(g)![]() N2(g) + 3H2(g) 的平衡常数K=_______ (mol/L)2。
N2(g) + 3H2(g) 的平衡常数K=_______ (mol/L)2。
③若保持温度和体积不变,起始投入的N2、H2、NH3的物质的量分别为a mol、b mol、c mol,达到平衡后,NH3的浓度与上表中相同的为_______(填选项字母)。
A.a=l、b=3、c=0 B.a=4、b=12、c=0
C.a=0、b=0、c=4 D.a=l、b=3、c=2
(2)另据报道,常温、常压下,N2在掺有少量氧化铁的二氧化钛催化剂表面能与水发生反应,生成NH3和O2。已知:H2的燃烧热ΔH=-286.0kJ/mol,则用N2与水反应制NH3的热化学方程式为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于常温下pH为2的硫酸,下列叙述正确的是
A. c(H+)=c(SO42-)+c(OH-)
B. 与等体积pH=12的氨水混合后所得溶液显酸性
C. 由H2O电离出的c(H+)=1.0×10-12 mol·L-1
D. 与等体积0.01 mol·L-1的乙酸钠溶液混合后所得溶液中:c(SO42-)=c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,下列溶液的离子浓度关系式正确的是
A. pH=5的H2S溶液中,c(H+)= c(HS-)=1×10—5mol·L—1
B. pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1
C. pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+ c(H+)= c(OH-)+c( HC2O4-)
D. pH相同的①CH3COO Na②NaHCO3③NaClO三种溶液的c(Na+):①>②>③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工业废催化剂含有SiO2、ZnO、CuS、ZnS、Fe3O4等物质,为落实“节约资源,变废为宝”的环保理念,某课外兴趣小组的同学取20g该物质进行实验,回收其中的Cu和Zn,实验方案如下:
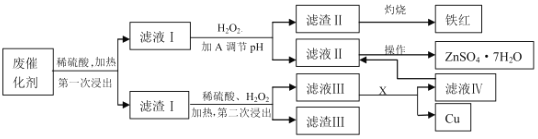
已知:ZnS可与稀硫酸反应;CuS不溶于稀硫酸,也不与其发生反应。请回答下列问题:
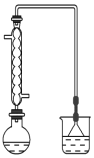
(1)可用图装置进行第一次浸出,烧杯中盛放的是______溶液。
(2)滤液Ⅰ中的Fe2+最好用______来检验。
a.氯水 b.双氧水 c.KSCN溶液 d.K3[Fe(CN)6]溶液
(3)物质A是含有X元素的氧化物(XO),则X是______(填元素符号),由滤液Ⅱ、Ⅳ滤液获得ZnSO47H2O的操作是______________。
(4)第二次浸出时的化学方程式为_______________。
(5)加A调节溶液的pH约为______时,可以完全除去其中的杂质离子。
(当溶液中离子浓度小于等于10-5mol/L时视为沉淀完全;实验条件下部分物质的溶度积常数为:Ksp[Fe(OH)3]=10-38,Ksp[Fe(OH)2]=10-17,Ksp[Zn(OH)2]=10-17,Ksp[Cu(OH)2]=10-20)
(6)实验最后获得了5.74gZnSO47H2O晶体(假设实验中没有损耗),但不能由此确定原催化剂中锌元素的质量分数,原因是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t ℃时,某NaOH稀溶液中c(H+)=10-a mol·L-1,c(OH-)=10-b mol·L-1。已知a+b=12,请回答下列问题:
(1)该温度下水的离子积常数Kw=________________。
(2)该溶液中由水电离出的c(OH-)=_________________。
(3)该温度下,将NH3溶于水得100 mL 0.1 mol·L-1的氨水,测得pH=9,则该条件下,NH3· H2O的电离平衡常数Kb为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。据此下列说法正确的是( )

A. 该硫酸的物质的量浓度为9.2mol/L
B. 盛放该试剂的包装上应标出图 所示的危险化学品标志
所示的危险化学品标志
C. 配制200mL 4.6mol/L的稀硫酸需取该硫酸50mL
D. 该硫酸与等体积的水混合所得溶液的质量分数小于49%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】aLCO和O2的混合气体,点燃后得到bL 气体(前后条件相同),则混和气体中CO的体积可能是下列组合中的( )
①b ②![]() a ③a-b ④a+b ⑤2(a-b)
a ③a-b ④a+b ⑤2(a-b)
A. ①②③B. ②④⑤C. ①③④D. ①②⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com