
【题目】在一定温度下,改变反应物中n(SO2)对反应2SO2(g)+O2(g) 2SO3(g) △H<0的影响如图所示,下列说法正确的是
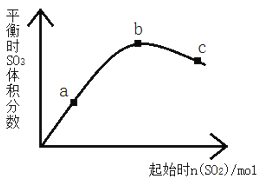
A. 反应b、c点均为平衡点,a点未达平衡且向正反应方向进行
B. a、b、c三点中,a点时SO2的转化率最高
C. 反应a、b、c点均为平衡点,b点时SO2的转化率最高
D. a、b、c三点的平衡常数Kb>Kc>Ka
 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案科目:高中化学 来源: 题型:
【题目】常温下,部分酸的电离平衡常数如下:
化学式 | HF | HCN | H2CO3 |
电离常数 | Ka=3.5×10-4 | Ka=5.0×10-10 | Ka1=4.3×10-7,Ka2=5.6×10-11 |
(1)c (H+)相同的三种酸,其酸的浓度从大到小为____________________。
(2)若HCN酸的起始浓度为0.0lmol/L,平衡时c(H+)约为____________mol/L。若使此溶液中HCN的电离程度增大且c(H+)也增大的方法是____________。
(3)中和等量的NaOH,消耗等pH的氢氟酸和硫酸的体积分别为aL、bL,则a______b (填“大于”、“小于”或“等于”)。中和等浓度、等体积的氢氟酸和硫酸需要NaOH的物质的量为n1、n2,则n1_________n2 (填“大于”、“小于”或“等于”)
(4)向NaCN中通入少量的CO2,发生的离子方程式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A.向蛋白质溶液中加入CuSO4溶液发生蛋白质变性
B.煤焦油中含有苯、二甲苯等化工原料
C.天然气和可燃冰的主要成分都是甲烷
D.石油裂解的主要目的是为了得到更多的汽油
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应:3A(g)![]() 3B(?)+C(?)△H>0,随着温度升高,气体平均相对分子质量有变小趋势,则下列判断正确的是( )
3B(?)+C(?)△H>0,随着温度升高,气体平均相对分子质量有变小趋势,则下列判断正确的是( )
A. B和C可能都是固体 B. 若C为固体,则B一定是气体
C. B和C一定都是气体 D. B和C不可能都是气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.葡萄糖和蔗糖互称同系物
B.等物质的量的甲烷和氯气反应可制取纯净的一氯甲烷
C.用NaOH溶液除去乙酸乙酯中混有的乙酸和乙醇
D.甲苯能发生氧化反应、加成反应和取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,某容器内发生反应N2(g)+3H2(g)![]() 2NH3(g),达到平衡的标志是
2NH3(g),达到平衡的标志是
A. 氨气、氮气、氢气的浓度相等B. 氮气和氢气的物质的量之比为1∶3
C. 氨气、氮气、氢气的浓度不变D. 恒温恒容时,混合气体的密度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中,反应aA(气)![]() bB(气)达到平衡后,保持温度不变,将容器体积增大一倍,当达到新平衡时,B的浓度是原来的60%,则
bB(气)达到平衡后,保持温度不变,将容器体积增大一倍,当达到新平衡时,B的浓度是原来的60%,则
A. 平衡向逆反应方向移动了 B. 物质A的转化率减小了
C. 物质B的质量分数增加了 D. a>b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨化学方程式 N2(g)+3H2(g)![]() 2NH3(g) △H=92.4 kJ/mol。将l mol N2(g)、3 mol H2(g)充入2 L的密闭容器中,在500℃下反应,10 min 时达到平衡,NH3的体积分数为
2NH3(g) △H=92.4 kJ/mol。将l mol N2(g)、3 mol H2(g)充入2 L的密闭容器中,在500℃下反应,10 min 时达到平衡,NH3的体积分数为![]() ,下列说法中正确的是
,下列说法中正确的是
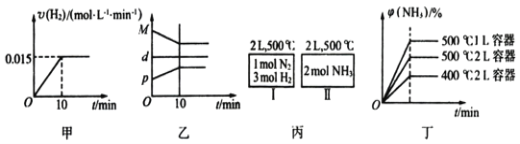
A. 若达到平衡时,测得体系放出9.24 kJ热量,则H2反应速率变化曲线如图甲所示
B. 反应过程中,混合气体平均相对分子质最M,混合气体密度d,混合气体压强p,三者关系如图乙所示
C. 图丙容器I和II达到平衡时,NH3的体积分数![]() ,则容器I放出热量与容器II吸收热量之和为92.4 kJ
,则容器I放出热量与容器II吸收热量之和为92.4 kJ
D. 若起始加入物料为1 mol N2,3 mol H2,在不同条件下达到平衡时,NH3的体积分数变化如图丁所示
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com