
| 浓H2SO4干燥 |
| ①足量饱和NaHCO3溶液 |
| ②浓H2SO4干燥 |
A、x=
| ||
B、y=
| ||
| C、x=y | ||
D、y=
|
| ||
| 4 |
| 3 |
| 8 |
| 3 |
| 8 |
| 3 |
| 4 |
| 3 |
| 8 |
| 3 |
| 4 |
| 3 |
| 8 |
| 3 |
| ||
| 4 |
| 3 |
| 8 |
| 3 |
| 8 |
| 3 |
| 4 |
| 3 |
| 8 |
| 3 |
| 4 |
| 3 |
| 8 |
| 3 |
| 4 |
| 3 |
| 8 |
| 3 |
| 4 |
| 5 |


科目:高中化学 来源: 题型:
| A、0.16 | B、0.08 |
| C、0.04 | D、0.02 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向蓝色的CoCl2盐酸溶液中加少量水,溶液变紫色 |
| B、工业合成氨常采用较高压强(20MPa~30 MPa)下进行,以提高原料利用率 |
| C、由H2(g)、I2(g)、HI(g)组成的平衡体系,压缩容器体积后颜色加深 |
| D、工业上生产硫酸的过程中使用适当过量的空气以提高二氧化硫的利用率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
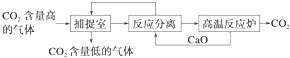
| A、①③ | B、②④ | C、③④ | D、①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①>② | B、①<② |
| C、①=② | D、不能确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Mg2+、H+、C1-、OH- |
| B、Na+、Ba2+、CO32-、NO3- |
| C、Na+、H+、Cl-、CO32- |
| D、K+、Cu2+、NO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2(g)的燃烧热△H=-285.8 kJ?mol-1 |
| B、1molH2O(l)变成1mo1H2O(g),吸收88kJ能量 |
| C、3H2(g)+CO2(g)=CH3OH(l)+H2O(l)△H=+135.9 kJ?mol-1 |
| D、可以寻找特殊催化剂使H2O分解,同时放出能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com