
| A、硫化亚铁溶于稀硝酸中:FeS+2H+=Fe2++H2S↑ |
| B、NH4HCO3溶于过量NaOH溶液中:HCO3-+OH-=CO32-+H2O |
| C、Na与CuSO4溶液反应:2Na+Cu2++2Na+ |
| D、向FeCl3溶液中加入Mg(OH)2+2Fe3+=Fe(OH)3↓+3Mg2+ |


 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源: 题型:
| 元素 | 相关信息 |
| X | X的最高价氧化物对应的水化物的化学式为H2XO3 |
| Y | Y是地壳中含量最高的元素 |
| Z | Z元素的最外层电子数与电子层数相同 |
| W | W的一种核素的质量数为28,中子数为14 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子半径:W>Z>Y>X |
| B、Y元素在周期表中的位置为第三周期第ⅣA族 |
| C、1mol甲与足量的乙完全反应共转移了1mol电子 |
| D、1.0L0.1mol?L-1戊溶液中阴离子总数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2.24L氨气中氨分子数目为0.2NA |
| B、1mol甲基中电子数目为9NA |
| C、1L0.1mol?L-1NaHCO3溶液中氧原子数目为0.3NA |
| D、7.8gNa2O2与足量H2O反应,转移电子数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铜片插入硝酸银溶液:Cu+Ag+=Cu2++Ag |
| B、在硫酸铜溶液中加入足量氢氧化钡溶液:Ba2++SO42-=BaSO4↓ |
| C、碳酸钠与稀硫酸混合,CO32-+2H+=CO2↑+H2O |
| D、铁溶解于稀盐酸:2Fe+6H+=2Fe3++3H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 编号 | 纯净物 | 混合物 | 弱电解质 | 非电解质 |
| A | 明矾 | 蔗糖 | Ba(OH)2 | CO2 |
| B | 聚乙烯 | 石膏 | CaCO3 | NH3 |
| C | 王水 | 冰 | H2SiO3 | Cl2 |
| D | 胆矾 | 玻璃 | H2SO3 | CH3CH2OH |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
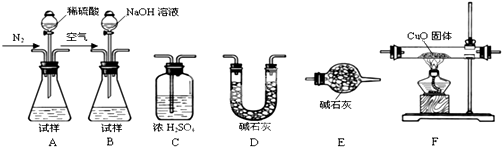

查看答案和解析>>
科目:高中化学 来源: 题型:
 短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如表所示.下列说法不正确的是
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如表所示.下列说法不正确的是| A、元素X与元素Z的最高正化合价之和的数值等于8 |
| B、离子Y2-和Z3+的核外电子数和电子层数均相同 |
| C、元素W的最高价氧化物对应的水化物的酸性比Q的弱 |
| D、元素X的气态氢化物的稳定性大于元素Y的气态氢化物的稳定性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com