
【题目】如图是某种有机物分子的球棍模型图,图中的“棍”代表单键或双键,不同大小的“球”代表不同的短周期元素的原子,对该有机物的叙述不正确的是
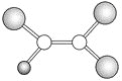
A. 该有机物可能的化学式为C2HCl3
B. 该有机物可以由乙烯和氯化氢通过加成反应得到
C. 该有机物分子中的所有原子在一个平面上
D. 该有机物分子中一定有碳碳双键
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案科目:高中化学 来源: 题型:
【题目】阿司匹林铜具有很强的抗炎作用。它是一种亮蓝色结晶粉末,不溶于水、醇、醚及氯仿等溶剂中。易受热分解成浅绿色混合物。在强酸条件下能解离出铜离子。合成阿司匹林铜,其实验流程如下:
已知反应方程式如下:
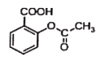 +NaOH→
+NaOH→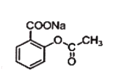 +H2O
+H2O
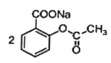 +CuSO4→
+CuSO4→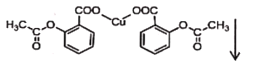 +Na2SO4
+Na2SO4
(1)下列有关说法正确的是_____。
A.反应1中加乙醇作溶剂,目的是增大接触面积,加快反应速率
B.用倾析法将反应2中的液体和沉淀同时转移到布氏漏斗中进行抽滤
C.洗涤操作中,可先用水洗2-3次,再用酒精洗涤2-3次
D.干燥后发现固体呈浅绿色,可能是烘干温度过高造成的结果
(2)反应1中的反应温度要求控制在室温的理由是______。
(3)阿司匹林铜中铜含量的测定,可用碘量法测定:
步骤一:准确称取0.800g样品,置于250mL锥形瓶中,加4mL3.00mol/L,再加20mL水,加热煮沸,样品完全分解后,摇匀,冷却到室温。
步骤二:往溶液中加入1.200gKI摇匀,用0.100mol/LNa2S2O3标准溶液滴定至溶液变浅黄色时,加入10mL 10% KSCN试剂,并加几滴淀粉溶液,继续用0.100mol/LNa2S2O3标准溶液滴定至终点,共消耗溶液体积为23.00mL。
已知:CuI难溶于水,能吸附碘;I2+2S2O32-=S4O62-+2I-。
CuI(s)+SCN-(aq)![]() CuSCN(s)+I-(aq)
CuSCN(s)+I-(aq)
①实验中加入10mL 10%KSCN试剂的目的是______。
②上述测定实验中,继续滴加Na2S2O3标准溶液至终点的具体实验操作______。
③该样品中的铜含量为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过渡金属元素如Fe、Mn、Cu、Ni可用作很多反应的催化剂,在室温下以H2O2为氧化剂直接将CH4氧化,回答下列问题:
(1)基态铜原子的核外电子排布式是___,第四周期元素中,基态原子未成对电子数最多的元素是____(填元素符号)
(2)C、H、O、Fe四种元素的电负性由大到小的顺序是____
(3)常温下,H2O2氧化CH4生成CH3OH、HCHO等
①CH3OH和HCHO的沸点分别是64.7℃、-19.5℃,其主要原因是____
②CH4、HCHO的键角较大的是___,原因是______
(4)Cu2+可与乙二胺(NH2CH2CH2NH2,简写为en)形成配合物,化学式为Cu(en)22+,乙二胺中与Cu2+形成配位键的原子是___(填元素符号),该配合物的配位数是__
(5)Cu晶胞结构如图所示,已知铜原子半径为apm,阿伏加德罗常数用NA表示,则铜晶体的密度为____g/cm3(写出计算表达式)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图①—⑩分别代表有关反应中的一种物质,其中③气体能使酚酞试液变红,⑦是红综色气体,回答:

(1)①中的混合气体通过浓硫酸发生化学反应,主要生成物的化学式是____。
(2)写出碳酸氢铵中阳离子的检验方法______________________________。
(3)写出工业上合成③的化学方程式__________________________________。
(4)⑧与⑨反应的化学方程式是______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学利用如下实验装置验证用蘸有浓氨水的棉签检验运送氯气的管道是否有氯气泄漏(已知:8NH3+3Cl2=N2+6NH4Cl)。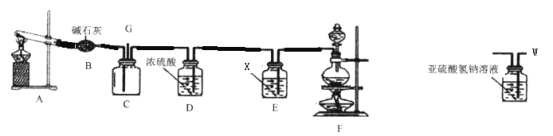
回答下列问题:
(1)写出A装置中反应的化学方程式________;
(2)试剂X为__________;
(3)写出装置F制取氯气的离子方程式为________;
(4)装置B的作用是_______,装置C中的现象是__________;
(5)G端连接上图装置W的作用是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠、钾与水反应的实验如下图所示:

(1)钠、钾与水反应两个实验现象的相同点:
①金属________水面上;
②金属________成闪亮的小球;
③小球四处游动;
④产生嘶嘶的声音;
⑤反应后的溶液使酚酞________。
(2)_______与水反应有轻微的爆鸣声,并很快燃烧起来。
(3)实验结论:________更易与水反应,且反应更_____________________________________。
(4)钾与水反应的化学方程式是___________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学兴趣小组设计以下实验方案,测定某已部分变质的小苏打样品中碳酸钠的质量分数。
[方案一]称取一定质量样品,置于坩埚中加热至恒重后,冷却,称量剩余固体质量,计算。
(1)坩埚中发生反应的化学方程式为____________。
(2)实验中,需加热至恒重的目的是_____________。
[方案二]称取一定质量样品,置于小烧杯中,加适量水溶解;向小烧杯中加入足量氢氧化钡溶液,过滤、洗涤、干燥沉淀,称量固体质量,计算。(已知:Ba2++OH-+HCO3-=BaCO3↓+H2O)。
(1)过滤操作中,除了烧杯、漏斗外,还要用到的玻璃仪器为__________。
(2)实验中判断沉淀是否完全的方法是__________。
[方案三]按如下图所示装置进行实验:
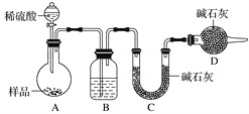
(1)D装置的作用是________,分液漏斗中_____(填“能”或“不能”)用盐酸代替稀硫酸进行实验。
(2)实验前称取17.90g样品,实验后测得C装置增重8.80g,则样品中碳酸钠的质量分数为________。
(3)根据此实验测得的数据,测定结果有误差,因为实验装置还存在一个明显缺陷是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学欲配制480 mL物质的量浓度为0.1mol·L-1的CuSO4溶液。
(1)完成该实验用到的仪器主要有:托盘天平、胶头滴管、烧杯、玻璃棒、药匙和____________。
(2)写出整个实验简单的操作过程:计算→称量→溶解→转移→____________→定容→摇匀。
(3)如果用CuSO4固体来配制,应该称量固体的质量为_________________;如果用CuSO4·5H2O来配制,应该称量固体的质量为____________________。
(4)下列操作使配制的溶液浓度偏低的是__________________。
A.配制的过程中有少量的液体溅出烧杯。
B.使用前容量瓶用蒸馏水洗涤,且没有干燥。
C.定容时俯视液面。
D.定容摇匀后,液面下降,又加水至刻度线。
(5)取配制好的溶液50 mL用水稀释到100 mL所得溶液中Cu2+的物质的量浓度为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一密闭容器中盛有甲烷,在隔绝空气条件下长时间加热到1000℃左右(假使甲烷完全分解),然后恢复至室温(20℃)。这时容器内气体的压强是原来甲烷压强的m倍,原来甲烷的密度是容器内气体密度的n倍。下列判断正确的是( )
A.m=2,n=0.25B.m=0.5,n=4C.m=2,n=4D.m=0.5,n=0.25
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com