
分析 ①油脂在碱性条件下发生水解反应为皂化反应,可制备肥皂;
②鸡蛋壳的成分为碳酸钙,与酸反应生成气体;
③甲醛、苯为常见的有机溶剂,均有毒;
④乙醇易挥发,吸收热量;
⑤蛋白质灼烧有烧焦羽毛的气味;
⑥聚乙烯无毒,可用于食品包装.
解答 解:①工业上制造肥皂的主要原料是E,故答案为:E;
②与鸡蛋壳反应有气体生成的是D,故答案为:D;
③家居装修材料中散发出的有毒物质是A和B,故答案为:A;B;
④有时医生要在某些发高烧病人身上涂擦C,因为该有机物蒸发时,会向人体吸热,故答案为:C;吸;
⑤灼烧有烧焦羽毛气味的是F,故答案为:F;
⑥可用于包装食品的塑料通常是G,故答案为:G.
点评 本题考查有机物的性质与应用,为高频考点,把握有机物的性质、性质与用途、化学与生活的联系为解答的关键,侧重分析与应用能力的考查,注意有机物性质的应用,题目难度不大.


科目:高中化学 来源: 题型:推断题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
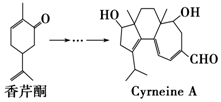 CyrneineA对治疗神经系统疾病有着很好的疗效,制备CyrneineA可用香芹酮经过多步反应合成:下列说法不正确的是( )
CyrneineA对治疗神经系统疾病有着很好的疗效,制备CyrneineA可用香芹酮经过多步反应合成:下列说法不正确的是( )| A. | 香芹酮化学式为C10H14O | |
| B. | CyrneineA可以发生加成反应、消去反应和氧化反应 | |
| C. | 香芹酮和CyrneineA均能使酸性KMnO4溶液褪色 | |
| D. | 与香芹酮互为同分异构体,分子中有4种不同化学环境的氢原子的酚类化合物共有4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{1}^{1}$H2O和${\;}_{1}^{2}$H2O | B. | 乙烯和丙烯(CH2═CHCH3) | ||
| C. | 石墨和C60 | D. | CH3CHCH3CH3和CH3CH2CH2CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ①②④ | C. | ①②③④ | D. | ①②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 从环境保护角度,氟氯代烷不宜用作制冷剂 | |
| B. | 聚氯乙烯制品适宜用于直接盛装食物 | |
| C. | 苯、甲苯、二甲苯都是基本的有机化工原料 | |
| D. | 乙烯用作果实催熟剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com