
【题目】将一小块钠投入到盛有100mL硫酸铜溶液的烧杯里,不可能观察到的现象是( )
A.钠熔成小球并在液面上四处游动B.有气体产生
C.烧杯底部有红色的物质生成D.溶液有蓝色沉淀生成
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:
【题目】电浮选凝聚法是工业上采用的一种污水处理方法,右图是电解污水的实验装置示意图,实验用污水中主要含有可被吸附的悬浮物(不导电).下列有关推断明显不合理的是( )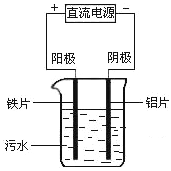
A.阴极的电极反应式为:O2+4e-+2H2O=4OH-
B.通电过程中烧杯内产生可以吸附悬浮物的Fe(OH)3
C.通电过程中会产生气泡,把悬浮物带到水面形成浮渣弃去
D.如果实验用污水导电性不良,可加入少量Na2SO4固体以增强导电性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿色化学实验”进课堂。钠与氯气反应的装置可作如图改进,将一根玻璃管与氯气发生器相连,玻璃管内放一块黄豆粒大的金属钠(已吸净煤油),玻璃管尾部塞一团浸有NaOH溶液的棉花球。先给钠预热,到钠熔融成圆球时,撤火,通入氯气,即可见钠着火燃烧,生成大量白烟。以下叙述错误的是( ) 
A.反应生成的大量白烟属于胶体
B.玻璃管尾部塞一团浸有NaOH溶液的棉球是用于吸收过量的氯气,以免其污染空气
C.钠着火燃烧产生苍白色火焰
D.钠与氯气反应的反应物具有的总能量大于生成物具有的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化一定属于化学变化的是( ) ①导电②爆炸③缓慢氧化④SO2使品红溶液褪色⑤无水硫酸铜由白变蓝⑥工业制O2⑦白磷转化为红磷 ⑧久置浓硝酸变黄⑨16O与18O间的相互转化.
A.②③④⑦⑧⑨
B.③④⑤⑦⑧
C.②③⑥⑦⑨
D.④⑤⑥⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列做法会对人体健康造成较大危害的是( )
A. 用小苏打(NaHCO3)焙制糕点
B. 用大量SO2漂白馒头
C. 用食醋清洗热水瓶胆内壁附着的水垢(CaCO3)
D. 用消毒液(有效成分NaClO)对医用物品进行杀菌消毒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物有重要用途,如聚合硫酸铁[Fe2(OH)n(SO4)3-n/2]m是一种新型高效的水处理混凝剂,而高铁酸钾(其中铁的化合价为+6)是一种重要的杀菌消毒剂,某课题小组设计如下方案制备上述两种产品:

请回答下列问题:
(1)若A为H2O(g),可以得到Fe3O4,写出H2O的电子式:________________。
(2)若B为NaClO3与稀硫酸,写出其氧化Fe2+生成Fe3+的离子方程式___________________。
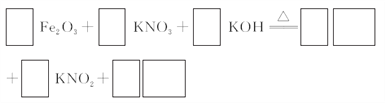
(3)若C为KNO3和KOH的混合物,写出其与Fe2O3加热共熔制得高铁酸钾的化学方程式,并配平:___________
(4)为测定溶液Ⅰ中铁元素的总含量,实验操作如下:准确量取20.00 mL溶液Ⅰ于带塞锥形瓶中,加入足量H2O2,调节pH<3,加热除去过量H2O2;加入过量KI充分反应后,再用0.1 00 0 mol·L-1 Na2S2O3标准溶液滴定至终点,消耗标准溶液20.00 mL。
已知:2Fe3++2I-===2Fe2++I2 ;I2+2S2O![]() ===2I-+S4O
===2I-+S4O![]() 。
。
①写出滴定选用的指示剂________,滴定终点观察到的现象_______________________。
②溶液Ⅰ中铁元素的总含量为__________g·L-1。若滴定前溶液中H2O2没有除尽,所测定的铁元素的含量将会________(填“偏高”“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为实验室制氢气的简易装置。若在加稀硫酸时,发现锌粒与稀硫酸没有接触而稀硫酸又不够了,为使该反应顺利进行,则可以从长颈漏斗中加入的试剂是( )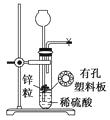
①食盐水②KNO3溶液③适量稀硫酸铜溶液
④Na2CO3溶液⑤CCl4⑥浓氨水
A.①③⑤
B.②⑥
C.③⑤
D.①②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废水中含有流失的生产用料、中间产物和产品,以及生产过程中产生的污染物.随着工业的迅速发展,废水的排放量迅速增加,严重威胁人类的健康和安全,工业废水的处理比城市污水的处理更为重要.图是含铬工业废水和含氰废水的处理流程: 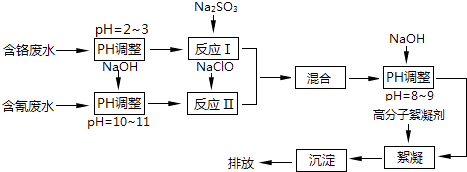
请回答下列问题:
(1)电镀废水中的铬主要以CrO42﹣形式存在,其中Cr元素的化合价为 .
(2)酸性条件下,CrO42﹣极易被还原剂还原为毒性较小的Cr3+ . 图中“反应Ⅰ”的离子方程式为 .
(3)pH>10时,“反应Ⅱ”中的NaClO可快速地将氰离子(CN﹣)氧化为无毒的两种物质,这两种物质是、(写化学式);若pH<8.5,则生成剧毒的CNCl气体(沸点13.1℃),写出该反应的离子方程式 .
(4)经过“反应Ⅰ”和“反应Ⅱ”将两种废水混合的目的是 .
(5)含氰废水及含铬废水可以通过电化学的方法进行无害化处理. ①可采用惰性电极对含氰废水进行电解,氰离子在碱性条件下被氧化为无毒的物质,该电解工艺中,阳极电极反应是 .
②电解法处理酸性含铬废水(若铬元素以Cr2O72﹣形式存在)时,以铁板和石墨作电极,处理过程中存在反应Cr2O72﹣+6Fe2++14H+=2Cr3++6Fe3++7H2O.则阳极的电极反应式为 , 当有1mol Cr2O72﹣被还原时,电路中转移的电子为mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化氢是重要的氧化剂、还原剂,它的水溶液又称为双氧水,常用作消毒、杀菌、漂白等。某化学兴趣小组取一定量的过氧化氢溶液,测定过氧化氢的含量。
请填写下列空白:
(1)移取10.00 mL密度为ρ g/mL的过氧化氢溶液至250 mL(填仪器名称)中,加水稀释至刻度,摇匀。移取稀释后的过氧化氢溶液25.00 mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样。
(2)用高锰酸钾标准溶液滴定被测试样,其反应的离子方程式:
(3)滴定时,将高锰酸钾标准溶液注入(填“酸式”或“碱式”)滴定管中。滴定到达终点的现象是。
(4)重复滴定三次,平均耗用c mol/L KMnO4标准溶液V mL,则原过氧化氢溶液中过氧化氢的质量分数为。
(5)若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果(填“偏高”、“偏低”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com