
【题目】下列各项正确的是
A. 钠与水反应的离子方程式:Na+H2O = Na++OH-+H2↑
B. 氯气与水反应的离子方程式:Cl2+H2O![]() 2H++Cl-+ClO-
2H++Cl-+ClO-
C. AlCl3溶液中滴入过量的氨水:Al3++3NH3·H2O = Al(OH)3↓+3NH4+
D. 钠和硫酸铜溶液反应的离子方程式:2Na+Cu2+ = 2Na++Cu
【答案】C
【解析】
A. 原子不守恒;
B. 次氯酸为弱酸,写化学式,不能拆;
C. 氯水为弱碱,可以与铝盐制备氢氧化铝沉淀;
D. 钠投入到盐溶液,首先与水反应生成氢氧化钠与氢气。
A. 钠与水反应的离子方程式:2Na+2H2O = 2Na++2OH-+H2↑,故A项错误;
B. HClO为弱电解质,在离子方程式书写时,应写成化学式,则氯气与水反应的离子方程式:Cl2+H2O![]() H++Cl-+HClO,故B项错误;
H++Cl-+HClO,故B项错误;
C. Al(OH)3不溶于弱碱,则AlCl3溶液中滴入过量的氨水的离子方程式为:Al3++3NH3·H2O = Al(OH)3↓+3NH4+,故C项正确;
D. 钠化学性质很活泼,与硫酸铜溶液反应时,先与水反应生成氢氧化钠与氢气,生成的氢氧化钠再继续与溶质硫酸铜反应生成氢氧化铜沉淀,其离子方程式:2Na+Cu2++2H2O= 2Na++Cu(OH)2↓+H2↑,故D项错误;
答案选C。


科目:高中化学 来源: 题型:
【题目】向NaOH和Na2CO3的混合溶液中滴加0.1mol/L稀盐酸,CO2的生成量与加入盐酸的体积(V)的关系如下图所示。下列判断正确的是

A. 在0-a范围内,只发生中和反应
B. ab段发生反应的离子方程式为CO32- +2H+ = CO2 ↑+H2O
C. a = 0.3
D. 原混合溶液中NaOH和Na2CO3的物质的量之比为1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:

(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
①电解池中X极上的电极反应式为 。在X极附近观察到的现象是 。
②Y电极上的电极反应式为 ,检验该电极反应产物的方法是 。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
①X电极的材料是 ,电极反应式是 。
②Y电极的材料是 ,电极反应式是 。
(说明:杂质发生的电极反应不必写出)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化氢H2O2(氧的化合价为﹣1价),俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口。对于下列A~D涉及H2O2的反应,填写空白:
A.Na2O2+2HCl===2NaCl+H2O2
B.Ag2O+H2O2===2Ag+O2+H2O
C.2H2O2===2H2O+O2
D.3H2O2+Cr2(SO4)3+10KOH===2K2CrO4+3K2SO4+8H2O
(1)H2O2仅体现氧化性的反应是_________(填代号)。
(2)H2O2既体现氧化性又体现还原性的反应是_________(填代号)。
(3)在稀硫酸中,KMnO4和H2O2能发生氧化还原反应。
氧化反应:H2O2﹣2e﹣===2H++O2↑
还原反应:MnO![]() +5e﹣+8H+===Mn2++4H2O
+5e﹣+8H+===Mn2++4H2O
写出该氧化还原反应的离子方程式:___________________。
(4)在K2Cr2O7+14HCl===2KCl+3Cl2↑+7H2O+2CrCl3的反应中,有0.3 mol电子转移时生成Cl2的体积为______(标准状况),被氧化的HCl的物质的量为____。
(5)除去镁粉中混入的铝粉杂质用溶解、_______方法,化学反应方程式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要0.80 mol·L-1 NaOH溶液475 mL 和0.40 mol·L-1硫酸500 mL。根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是____________(填序号),配制上述溶液还需用到的玻璃仪器是____________________(填仪器名称)。
(2)容量瓶所不具备的功能有________(填序号)。
A.配制一定体积准确浓度的标准溶液
B.量取一定体积的液体
C.测量容量瓶规格以下的任意体积的液体
D.贮存溶液
E.用来加热溶解固体溶质
(3)根据计算用托盘天平称取NaOH的质量为___________g。
(4)在实验中其他操作均正确,若容量瓶用蒸馏水洗涤后未干燥,则所得溶液浓度________0.80 mol·L-1(填“大于”“等于”或“小于”,下同)。若还未等溶液冷却就定容了,则所得溶液浓度________0.80 mol·L-1。
(5)根据计算得知,所需质量分数为98%、密度为1.84 g·cm-3的浓硫酸的体积为________mL(计算结果保留一位小数)。如果实验室有10 mL、15 mL、20 mL、50 mL的量筒,最好选用________mL的量筒。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学为探究 H2O2、 H2SO3、 Br2 氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验)。
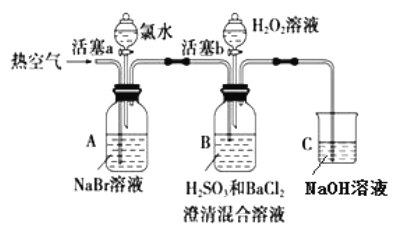
实验记录如下:
实验操作 | 实验现象 | |
① | 打开活塞 a,滴加氯水,关闭活塞 a | _____________________________________________ |
② | 吹入热空气一段时间后停止 | A中溶液颜色明显变浅;B中有气泡,产生大量白色沉淀,沉降后上层清液为无色 |
③ | 打开活塞b,逐滴加入H2O2溶液 | 开始时溶液颜色无明显变化;继续滴加H2O2溶液,一段时间后,混合液逐渐变成橙红色。 |
完成下列填空:
(1)在进行操作①时,A中的实验现象是___________,有关反应的离子方程式是___________。
(2)操作②吹入热空气的目的是____________。B 中产生白色沉淀的化学式是___________。
(3)装置C的作用是____________________。
(4)由上述实验可知,在此实验条件下,H2O2、H2SO3、Br2氧化性强弱顺序为________________。
(5)操作③开始时颜色无明显变化可能原因是(写出一条即可):___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液中可能含有Mg2+、Ba2+、Cl-、HCO3-中的一种或几种离子。为确定其成分,进行以下实验:
实验1:取l0mL无色溶液,滴加适量稀盐酸无明显现象。
实验2:另取l0mL无色溶液,加入足量的Na2SO4溶液,有白色沉淀生成。
实验3:将实验l后的溶液于锥形瓶中,向锥形瓶中逐滴加入NaOH溶液,滴加过程中产生沉淀的质量与加入NaOH溶液的体积的关系如图所示。

回答下列问题:
(1)原溶液中不存在的离子有________,存在的离子有___________________。
(2)实验3中,图像中OA段反应的离子方程式为___________________。
(3)根据图像计算原溶液中Mg2+的物质的量浓度______________。(写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知20℃时,饱和NaCl溶液的密度为ρg/cm3,物质的量浓度为c mol/L,则下列说法中不正确的是
A. 温度低于20℃时,饱和NaCl溶液的浓度小于c mol/L
B. 此溶液中NaCl的质量分数为![]()
C. 20℃时,密度小于ρg/cm3的NaCl溶液是不饱和溶液
D. 20℃时,饱和NaCl溶液的溶解度![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4molA气体和2molB气体在2L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g) 2C(g)。若经2s后测得C的浓度为0.6mol/L,现有几种说法:
①用物质A表示的反应的平均速率为0.3 mol/Ls
②用物质B表示的反应的平均速率为0.6 mol/Ls
③2s时物质A的转化率为70%
④2s时B物质的浓度为0.7 mol/L
其中正确的是( )
A. ①③ B. ①④ C. ②③ D. ③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com