
为了提高资源利用率,减少环境污染,化工集团将钛厂、氯碱厂和甲醇厂组成产业链,如图所示。

请填写下列空白:
(1)钛铁矿进入氯化炉前通常采取洗涤、粉碎、烘干、预热等物理方法处理,请从原理上解释粉碎的作用:_______________________________________;
已知氯化炉中反应氯气和焦炭的理论用料物质的量比为7∶6,则氯化炉中的还原剂化学式是_________________________________________________。
(2)已知:①Mg(s)+Cl2(g)=MgCl2(s) ΔH=-641 kJ·mol-1
②2Mg(s)+TiCl4(s)=2MgCl2(s)+Ti(s) ΔH=-512 kJ·mol-1
则Ti(s)+2Cl2(g)=TiCl4(s) ΔH=________。
(3)Ar气通入还原炉中并不参与反应,通入Ar气的作用是_________________________________________________________________。
(4)以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。已知该燃料电池的总反应式为2CH3OH+3O2+4OH-===2CO32—+6H2O,该电池中正极上的电极反应式为____________________________________________。
工作一段时间后,测得溶液的pH________(填“减小”、“增大”或“不变”)。
(1)增大反应物间接触面积,提高反应速率 C、FeTiO3
(2)-770 kJ·mol-1
(3)Mg和Ti都有强还原性,在Ar气氛围中可防止被氧化
(4)O2+2H2O+4e-=4OH-(或3O2+6H2O+12e-=12OH-) 减小
【解析】 (1)粉碎反应物,可以增大其表面积,从而增大反应物之间的接触面积,提高反应速率;氯化炉中发生的反应为6C+7Cl2+2FeTiO3=6CO+2TiCl4+2FeCl3,由此可知C和FeTiO3为还原剂。(2)根据盖斯定律,由①×2-②得:Ti(s)+2Cl2(g)=TiCl4(s) ΔH=-770 kJ·mol-1。(3)Ar气为惰性气体,可以防止Mg和Ti等具有强还原性的物质被氧化。(4)根据该电池的总反应式可知,反应过程中不断消耗OH-,则该电池工作一段时间后,溶液的pH将减小。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2014年高一下化学必修2 3-4-2糖类油脂蛋白质在生活中作用练习卷(解析版) 题型:选择题
下列关于油脂的叙述不正确的是( )。
A.油脂属于混合物
B.油脂密度比水小,不溶于水,会浮于水的上层
C.油脂在酸性或碱性条件下都比在纯水中难水解
D.各种油脂水解后的产物中都有甘油
查看答案和解析>>
科目:高中化学 来源:2014年化学高考题型专练十八 探究型综合实验题练习卷(解析版) 题型:实验题
用纯碱和双氧水混合可制作新型液体洗涤剂(2Na2CO3·3H2O2),它具有杀菌消毒去油污的能力且不会污染水源。
(1)检验这种新型洗涤剂中金属阳离子的操作和现象是_______________________________________。
(2)这种洗涤剂中的双氧水可以将废水中的氰化物转化为无毒物同时生成NH3,写出反应的离子方程式:___________________________________
(3)如果配制洗涤剂的水中含有铁离子,不仅会削弱洗涤剂的去污能力,甚至完全失去杀菌作用。试分析其中的原因(用离子方程式和简要文字表述):__________________________________________________________________
(4)某化学学习小组为定性探究铁离子对这种新型洗涤剂的不良影响,取该洗涤剂100 mL,加入25 gFeCl3固体,产生大量无色无味气体,用贮气瓶收集气体。请选用下列试剂和实验用品完成气体成分的探究过程:0.10 mol·L-1 NaOH溶液、8.0 mol·L-1 NaOH溶液、澄清石灰水、0.01 mol·L-1 KMnO4溶液、BaCl2稀溶液、品红溶液、蒸馏水、小木条、酒精灯、火柴、洗气瓶。
①提出假设:对该气体成分提出合理假设。
假设1:气体是O2;
假设2:气体是________________;
假设3:气体是CO2。
②设计方案:设计实验方案证明你的假设,在下表中完成实验步骤、预期现象与结论。
实验步骤 | 预期现象与结论 |
将气体依次通入盛有________、________的洗气瓶中,________ | __________________ |
查看答案和解析>>
科目:高中化学 来源:2014年化学高考题型专练十二 常见无机物的性质及其综合应用练习卷(解析版) 题型:选择题
下列有关N、S、Cl等非金属元素化合物的说法正确的是 ( )。
A.漂白粉的成分为次氯酸钙
B.实验室可用浓硫酸干燥氨气
C.实验室可用NaOH溶液处理NO2和HCl废气
D.Al2(SO4)3可除去碱性废水及酸性废水中的悬浮颗粒
查看答案和解析>>
科目:高中化学 来源:2014年化学高考题型专练十三 有机物结构及同分异构体数目判断练习卷(解析版) 题型:选择题
分子式为C10H14的一取代芳香烃,其可能的结构有 ( )。
A.3种 B.4种 C.5种 D.6种
查看答案和解析>>
科目:高中化学 来源:2014年化学高考题型专练十一 元素的单质及其化合物的性质与转化练习卷(解析版) 题型:选择题
某工厂用CaSO4、NH3、H2O、CO2制备(NH4)2SO4,其工艺流程如下:
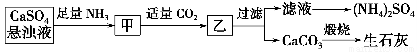
下列推断不合理的是 ( )。
A.生成1 mol(NH4)2SO4至少消耗2 mol NH3
B.CO2可被循环使用
C.往甲中通CO2有利于(NH4)2SO4的生成
D.直接蒸干滤液即可得到纯净的(NH4)2SO4
查看答案和解析>>
科目:高中化学 来源:2014年化学高考题型专练十 电解质溶液中微粒浓度的关系练习卷(解析版) 题型:选择题
下列各溶液中,微粒的物质的量浓度关系表述正确的是 ( )。
A.0.1 mol·L-1 Na2CO3溶液中:c(Na+)=c(HCO3—)+c(H2CO3)+2c(CO32—)
B.常温下,pH=4的醋酸与pH=10的NaOH溶液等体积混合后pH<7
C.将0.2 mol·L-1 NaA溶液和0.1 mol·L-1盐酸等体积混合所得碱性溶液中:c(Na+)+c(H+)=c(A-)+c(Cl-)
D.pH=12的Ba(OH)2溶液和pH=12的Na2CO3溶液中,水电离的c(H+)相等
查看答案和解析>>
科目:高中化学 来源:2014年化学高考题型专练八 化学反应速率和化学平衡分析与判断练习卷(解析版) 题型:选择题
某温度下,反应2A(g) B(g)(正反应为吸热反应)在密闭容器中达到平衡,平衡后
B(g)(正反应为吸热反应)在密闭容器中达到平衡,平衡后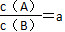 ,若改变某一条件,足够时间后反应再次达到平衡状态,此时
,若改变某一条件,足够时间后反应再次达到平衡状态,此时 ,下列叙述正确的是 ( )。
,下列叙述正确的是 ( )。
A.在该温度下,保持容积固定不变,向容器内补充了B气体,则a<b
B.若a=b,则B容器中一定使用了催化剂
C.若其他条件不变,升高温度,则有a<b
D.若保持温度、压强不变,充入惰性气体,则有a>b
查看答案和解析>>
科目:高中化学 来源:2014年化学高考题型专练一 化学与科学技术社会环境的关系练习卷(解析版) 题型:选择题
绿色化学实验是在绿色化学思想指导下的实验新方法,以减少污染,防止浪费等。下列符合绿色化学实验的是 ( )。
A.用铜与浓硫酸反应制取CuSO4,并用少量品红溶液吸收尾气
B.将CO还原Fe2O3后的尾气直接排入空气中
C.用CCl4完成萃取操作练习时,将溴水改成碘水
D.将Zn和稀硫酸反应制取H2后的废液倒入下水道后再清洗玻璃仪器
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com