
【题目】短周期主族元素X、Y、Z、W的原子序数依次增大,X的一种单质可以供给生物呼吸,Y原子的最外层有1个电子,Z是地壳中含量最多的金属元素,W与X位于同一主族。下列说法正确的是( )
A.原子半径:![]()
B.由X、Y组成的化合物是共价化合物
C.W的简单气态氢化物的热稳定性比X的强
D.Z的最高价氧化物对应水化物的碱性比Y的强
【答案】A
【解析】
X的一种单质可以供给生物呼吸,故X为O,因Y的原子序数比X大且为短周期元素,结合Y原子的最外层有1个电子可知,Y为Na,Z 是地壳中含量最多的金属元素,故Z为Al,W与X位于同一主族,故W为S,以此解答。
A.O原子核外电子层数最少,其半径最小,Na、Al、S为同周期元素,从左至右原子半径逐渐减小,故半径:r(Na)> r(Al)> r(S)> r(O),故A正确;
B.O与Na形成的化合物均为离子化合物,故B错误;
C.因非金属性:O>S,因此其简单氢化物的稳定性:H2O>H2S,故C错误;
D.因金属性:Na>Al,因此其最高价氧化物对应水化物的碱性:NaOH>Al(OH)3,故D错误;
故答案为:A。


科目:高中化学 来源: 题型:
【题目】在防治新冠肺炎的工作中,过氧乙酸(CH3COOOH)是众多消毒剂中的一种。过氧乙酸具有强氧化能力,可将各种病原微生物杀灭。其性质不稳定,遇热易分解。某同学利用高浓度的双氧水和冰醋酸制备少量过氧乙酸并进行相关实验。
I.过氧乙酸的制备.
向100mL的三颈烧瓶中加入25mL冰醋酸,滴加42.5%双氧水15mL,之后加入一定量浓硫酸,维持反应温度为40℃,磁力搅拌4h后,室温静置12h。
(1)三颈烧瓶中制取过氧乙酸的反应方程式为____。
(2)资料显示浓硫酸的用量对制得的过氧乙酸的质量分数有较为明显的影响,如图所示。根据图中数据分析本实验中浓硫酸的用量应为____(填字母)。
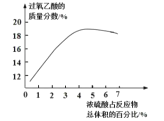
a 1.5mL-2.0mL b 3.5mL-4.0mL C 5.5mL-6.0mL
II.过氧乙酸质量分数的测定
准确称取1.00g过氧乙酸样液,定容子100mL容量瓶中,取其中10.00mL溶液调pH后,用KMnO4标准溶液滴定至溶液出现浅红色,以除去过氧乙酸试样中剩余的H2O2,再加入过量KI溶液,摇匀,用0.0200mol/LNa2S2O3标准溶液滴定至终点,消耗Na2S2O3标准溶液25.00mL。(已知:![]() )。
)。
(3)加入过量KI溶液前,需除去H2O2的原因是____(用离子方程式表示)。
(4)滴定时所选指示剂为____;制得过氧乙酸溶液中过氧乙酸质量分数为____%。
(5)过氧乙酸用于消毒时,要将原液稀释到0.2%-0.5%之间。若实验室配制1000mL过氧乙酸稀溶液时,除需使用烧杯和玻璃棒外,还要用到以下哪些仪器____(填标号)。
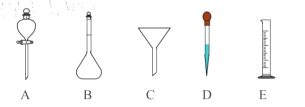
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)84消毒液的有效成分是_____。
(2)O2F2为共价化合物,各原子均满足8电子稳定结构,写出O2F2的电子式_____。
(3)NaOH的碱性比Mg(OH)2强,主要原因是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂-硫电池具有高能量密度、续航能力强等特点。使用新型碳材料复合型硫电极的锂-硫电池工作原理示意图如图,下列说法正确的是
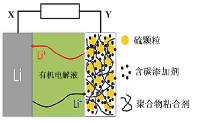
A.电池放电时,X电极发生还原反应
B.电池充电时,Y电极接电源正极
C.电池放电时,电子由锂电极经有机电解液介质流向硫电极
D.向电解液中添加Li2SO4水溶液,可增强导电性,改善性能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溶洞的形成主要源于石灰岩受地下水的长期溶蚀,发生反应:CaCO3+CO2+H2O=Ca(HCO3)2。当受热或压强突然减小时溶解的Ca(HCO3)2会分解,从而形成钟乳石、石笋等奇妙景观。
(1)写出Ca(HCO3)2受热分解的离子方程式____;从平衡移动的角度解释压强减小时Ca(HCO3)2分解的原因_______。
(2)向Ca(HCO3)2饱和溶液中滴加酚酞,溶液呈很浅的红色。由此可得到的结论是:饱和溶液中Ca(HCO3)2水解程度__________且___________。
(3)常温下,H2CO3的电离常数Ka2=4.7×10-11。若测得5.0×10-3 mol/L Ca(HCO3)2溶液的pH为8.0,则溶液中c(CO32-)与c(OH-)的比值为___________(简要写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组在实验室进行如下实验探究活动。
(1)设计如下实验研究2Fe3++2I-![]() 2Fe2++I2的反应。
2Fe2++I2的反应。

①振荡静置后C中观察到的现象是_______________________;为证明该反应存在一定限度,还应补做实验为:取C中分液后的上层溶液,然后______________(写出实验操作和现象)。
②测定上述KI溶液的浓度,进行以下操作:
I用移液管移取20.00 mL KI溶液至锥形瓶中,加入适量稀硫酸酸化,再加入足量H2O2溶液,充分反应。
II小心加热除去过量的H2O2。
III用淀粉做指示剂,用c mol/L Na2S2O3标准溶液滴定,反应原理为:2Na2S2O3+I2=2NaI+Na2S4O6。
步骤II是否可省略?____________(答“可以”或“不可以”)
步骤III达到滴定终点的现象是___________________________。巳知I2浓度很高时,会与淀粉形成稳定的包合物不易解离,为避免引起实验误差,加指示剂的最佳时机是________。
(2)探究Mn2+对KMnO4酸性溶液与H2C2O4溶液反应速率的影响。
反应原理(化学方程式)为________;
仪器及药品:试管(两支)、0.01 mol/L KMnO4酸性溶液、0.1 mol/L H2C2O4溶液、一粒黄豆大的MnSO4固体;
实验方案:请仿照教材(或同教材)设计一个实验用表格,在行标题或列标题中注明试剂及观察或记录要点。______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】呋喃酚是合成农药的重要中间体,其合成路线如下:
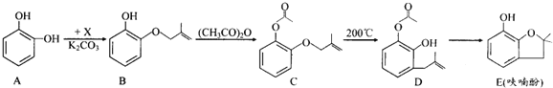
(1)A在空气中久置会由无色转变为棕褐色,其原因是____________,A在核磁共振氢谱中有___________组峰。
(2)B→C的反应类型是_____________________。
(3)已知X的分子式为C4H7Cl。写出A→B的化学方程式:___________________。
(4)要鉴别化合物C和D,适宜的试剂是__________________________。
(5)B的同分异构体很多,符合下列条件的有______种,写出其中能发生银镜反应的同分异构体的结构简式:__________(任写一种)。
①苯的衍生物 ②有两个互为对位的取代基 ③含有酯基
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)聚四氟乙烯商品名称为“特氟龙”,可做不粘锅涂层。它是一种准晶体,该晶体是一种无平移周期序、但有严格准周期位置序的独特晶体。可通过___方法区分晶体、准晶体和非晶体。
(2)下列氮原子的电子排布图表示的状态中,能量由低到高的顺序是___(填字母代号)。
A.![]() B.
B.![]()
C.![]() D.
D.![]()
(3)某种铀氮化物的晶体结构是NaCl型。NaCl的Bom-Haber循环如图所示。已知:元素的一个气态原子获得电子成为气态阴离子时所放出的能量称为电子亲和能。下列有关说法正确的是__(填标号)。
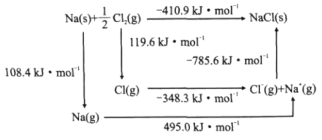
a.Cl-Cl键的键能为119.6kJ/mol b.Na的第一电离能为603.4kJ/mol
c.NaCl的晶格能为785.6kJ/mol d.Cl的第一电子亲和能为348.3kJ/mol
(4)配合物[Cu(En)2]SO4的名称是硫酸二乙二胺合铜(Ⅱ),是铜的一种重要化合物。其中En 是乙二胺(H2N-CH2-CH2-NH2)的简写。
①该配合物中含有化学键有___(填字母编号)。
A.离子键 B.极性共价键 C.非极性共价键 D.配位键 E.金属键
②配体乙二胺分子中氮原子、碳原子轨道的杂化类型分别为___、___。
③乙二胺和三甲胺[N(CH3)3]均属于胺,且相对分子质量相近,但乙二胺比三甲胺的沸点高得多,原因是___。
④乙二胺(H2NCH2CH2NH2)是一种有机化合物,乙二胺能与Mg2+、Cu2+等金属离子形成稳定环状离子,其原因是___,其中与乙二胺形成的化合物稳定性相对较高的是___(填“Mg2+”或“Cu2+”)。
⑤与氨气互为等电子体的阳离子为___,与S位于同一周期,且第一电离能小于S的非金属元素符号为___。
(5)①金属钛的原子堆积方式如图1所示,则金属钛晶胞俯视图为____。

A. B.
B.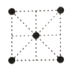 C.
C. D.
D.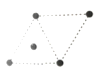
②某砷镍合金的晶胞如图所示,设阿伏加德罗常数的值为NA,该晶体的密度ρ=__g·cm-3。
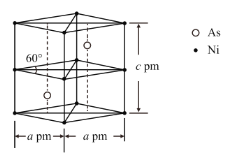
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.将CH3COONa溶液从20 ℃升温到30 ℃,溶液中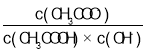 增大
增大
B.pH相同的①CH3COONa ②NaHCO3 ③NaClO三种溶液的c(Na+):①>②>③
C.CH3COONa和CaCl2混合溶液:c(Na+)+c(Ca2+)=c(CH3COO-)+c(CH3COOH)+2c(Cl-)
D.Na2CO3溶液中加入少量Ca(OH)2固体,CO32-水解程度减小,溶液的pH减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com