
【题目】石墨烯是目前科技研究的热点,可看作将石墨的层状结构一层一层的剥开得到的单层碳原子(结构如图所示);将氢气加入到石墨烯中开发出一种具有突破性的新材料石墨烷,下列说法中正确的是( )
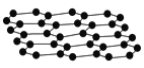
A.石墨烯是高分子化合物
B.12 g的石墨烯中含有3NA个C-C键
C.一定条件下石墨烯可与H2发生加成反应
D.根据结构示意图可知,石墨烯不能导电
科目:高中化学 来源: 题型:
【题目】如图是一个制取氯气并以氯气为原料进行特定反应的装置。
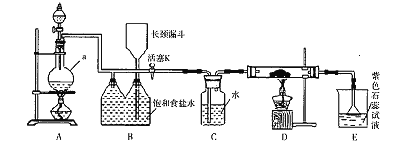
(l)A是氯气发生装置,写出其中的化学反应方程式___________。
(2)a仪器的名称为___________。
(3)实验开始时,先点燃A处的酒精灯,打开活塞K,让氯气充满整个装置,再点燃D处酒精灯,连接上E装置。D装置的硬质玻璃管内盛有炭粉,反应产物为CO2和HC1。写出D中反应的化学方程式_________,装置C的作用是__________。
(4)在E处,若漏斗内气体带有黄绿色,则紫色石蕊试液的颜色变化为_______。
(5)若将E处烧杯中溶液改为澄清石灰水,反应过程中现象为___________(填序号)。
①有白色沉淀生成;②无白色沉淀生成;③先生成白色沉淀,而后白色沉淀消失。
(6)D处反应完毕后,关闭活塞K,移去酒精灯,由于余热的作用,A处仍有Cl2产生,则装置B中的现象是________;若发现装置B中该现象不明显,可能的原因是________;查找原因时可用肥皂水或湿润的碘化钾淀粉试纸等,若用蘸有浓氨水的玻璃棒检查时观察到有白烟产生,写出该氧化还原反应的化学方程式_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环之间共用一个碳原子的化合物称为螺环化合物。1,4-二氧杂螺[2.2]丙烷的结构简式为![]() 。下列说法正确的是
。下列说法正确的是
A. 1mol该有机物完全燃烧需要4molO2
B. 该有机物与 HCOOCH=CH2互为同分异构体
C. 该有机物的二氯代物有3种
D. 该有机物所有原子均处于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.摩尔是用来衡量微观粒子多少的一种物理量
B.标况下O2的体积取决于O2分子间的距离
C.常温常压下4.8g O3含有的氧原子为0.3NA
D.若气体摩尔体积为22.4 L/mol,,则所处条件为标准状况
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列实验事实的理论解释错误的是( )
选项 | 实验事实 | 理论解释 |
A | 酸性:H2SO4>H2SO3 | H2SO4非羟基氧原子个数大于H2SO3,中心原子正电性越高,酸性越强 |
B | Be单质能溶于KOH溶液 | Be和Al在周期表中是对角线关系,性质相似 |
C | Al原子的第一电离能大于Mg原子 | Mg的金属性比Al强,更容易失去电子 |
D | 沸点:对羟基苯甲醛>邻羟基苯甲醛 | 对羟基苯甲醛存在分子间氢键,邻羟基苯甲醛存在分子内氢键,分子间氢键对它们沸点的影响大于分子内氢键对它们沸点的影响 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某元素原子的核电荷数是电子层数的5倍,其质子数是最外层电子数的3倍,该元素的原子结构示意图是________。
(2)已知某粒子的结构示意图为![]()
试回答:
①当x-y=10时,该粒子为________(填“原子”、“阳离子”或“阴离子”)。
②当y=8时,粒子可能为(填名称)________、________、________、________、________。
③写出y=3与y=7的元素最高价氧化物对应水化物发生反应的离子方程式__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C为短周期元素,在周期表中所处的位置如图所示。A、C两元素的原子核外电子数之和等于B原子的质子数,B原子核内质子数和中子数相等。

(1)写出A、B、C的名称:A_____、B_____、C_____。
(2)C在元素周期表中的位置是_____。
(3)B的原子结构示意图为_____,C的氢化物与B的氢化物的稳定性强弱顺序 > (填化学式)。_______
(4)比较A、C的原子半径:A_____(填“>”“<”或“=”)C。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】孔雀石的主要成分是Cu2(OH)2CO3(含Fe2O3、FeCO3、Al2O3、SiO2杂质),工业上用孔雀石制备硫酸铜的第一步需用过量的硫酸溶解并过滤。常温下,分别取滤液并向其中加入指定物质,反应后的溶液中大量存在的离子组正确的是
A. 加入过量氨水:Fe3+、NH4+、SO42-、OH-
B. 加入过量NaClO溶液:Fe2+、Na+、ClO-、SO42-
C. 加入过量NaOH溶液:Na+、AlO2-、SO42-、OH-
D. 加入过量NaHCO3溶液:Na+、Al3+、SO42-、HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
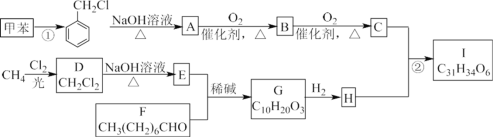
【题目】高血脂是一种常见的心血管疾病,治疗高血脂的新药 I 的合成路线如下:
已知:a. 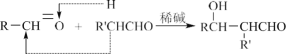 b.
b. 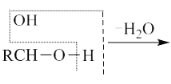 RCHO
RCHO
回答下列问题:
(1)反应①所需试剂、条件分别是________;F 的化学名称为________
(2)②的反应类型是________;A→B 的化学方程式为________。
(3) G 的结构简式为________;H 中所含官能团的名称是________。
(4)化合物 W 的相对分子质量比化合物 C 大 14,且满足下列条件:①遇 FeCl3 溶液显紫色 ②属于芳香族化合物
③能发生银镜反应,W 的可能结构有________种,其中核磁共振氢谱显示有 5 种不同化学环境的氢,峰面积比为2:2:2:1:1 的结构简式为________。
(5)设计用甲苯和乙醛为原料制备 ![]() 的合成路线________ (无机试剂任选)。
的合成路线________ (无机试剂任选)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com