
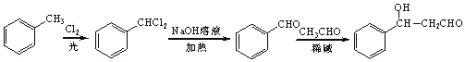
【题目】高血脂是一种常见的心血管疾病,治疗高血脂的新药 I 的合成路线如下:
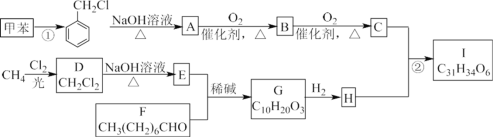
已知:a. 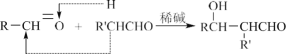 b.
b. 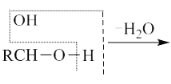 RCHO
RCHO
回答下列问题:
(1)反应①所需试剂、条件分别是________;F 的化学名称为________
(2)②的反应类型是________;A→B 的化学方程式为________。
(3) G 的结构简式为________;H 中所含官能团的名称是________。
(4)化合物 W 的相对分子质量比化合物 C 大 14,且满足下列条件:①遇 FeCl3 溶液显紫色 ②属于芳香族化合物
③能发生银镜反应,W 的可能结构有________种,其中核磁共振氢谱显示有 5 种不同化学环境的氢,峰面积比为2:2:2:1:1 的结构简式为________。
(5)设计用甲苯和乙醛为原料制备 ![]() 的合成路线________ (无机试剂任选)。
的合成路线________ (无机试剂任选)。
【答案】氯气、光照 辛醛 酯化反应或取代反应 ![]()
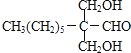 羟基 13
羟基 13 ![]()
【解析】
甲苯在光照条件下与氯气发生取代反应生成![]() ,
,![]() 水解得到A为
水解得到A为![]() ,A氧化生成B为
,A氧化生成B为![]() ,B进一步氧化生成C为
,B进一步氧化生成C为![]() ,甲烷和氯气在光照条件下发生取代反应生成D(CH2Cl2),D在氢氧化钠的水溶液、加热条件下发生取代反应,但同一个碳原子上含有两个羟基不稳定会失水生成醛,则E为HCHO,CH3(CH2)6CHO和甲醛反应生成G,根据题给信息知G为
,甲烷和氯气在光照条件下发生取代反应生成D(CH2Cl2),D在氢氧化钠的水溶液、加热条件下发生取代反应,但同一个碳原子上含有两个羟基不稳定会失水生成醛,则E为HCHO,CH3(CH2)6CHO和甲醛反应生成G,根据题给信息知G为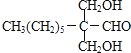 ,G和氢气发生加成反应生成H为
,G和氢气发生加成反应生成H为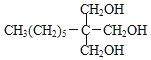 ,C与H发生酯化反应生成I为
,C与H发生酯化反应生成I为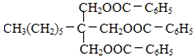 ,苯与氯气在光照条件下生成
,苯与氯气在光照条件下生成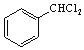 ,然后发生水解反应生成
,然后发生水解反应生成![]() ,最后与乙醛在碱性条件下反应生成目标物。
,最后与乙醛在碱性条件下反应生成目标物。
(1)反应①是甲苯转化为![]() ,所需试剂、条件分别是氯气、光照;F的化学名称为辛醛;故答案为:氯气、光照;辛醛。
,所需试剂、条件分别是氯气、光照;F的化学名称为辛醛;故答案为:氯气、光照;辛醛。
(2)反应②是酯化反应,也属于取代反应;A→B的化学方程式为:![]() ;故答案为:酯化反应或取代反应;
;故答案为:酯化反应或取代反应;![]() 。
。
(3)G的结构简式为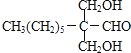 ;H为
;H为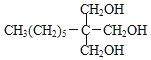 ,所含官能团的名称是羟基;故答案为:
,所含官能团的名称是羟基;故答案为: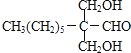 ;羟基。
;羟基。
(4)化合物W的相对分子质量比化合物C(![]() )大14,W比C多1个CH2原子团,W满足下列条件:①遇FeCl3溶液显紫色,说明含有酚羟基,②属于芳香族化合物,即含有苯环,③能发生银镜反应,还含有醛基,含有2个侧链为—OH、—CH2CHO
)大14,W比C多1个CH2原子团,W满足下列条件:①遇FeCl3溶液显紫色,说明含有酚羟基,②属于芳香族化合物,即含有苯环,③能发生银镜反应,还含有醛基,含有2个侧链为—OH、—CH2CHO![]() ;故答案为:13;
;故答案为:13;![]() 。
。
(5)苯与氯气在光照条件下生成 ,然后发生水解反应生成
,然后发生水解反应生成![]() ,最后与乙醛在碱性条件下反应生成目标物,合成路线流程图为:
,最后与乙醛在碱性条件下反应生成目标物,合成路线流程图为: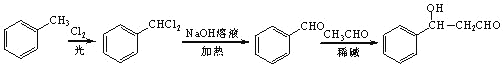 ;故答案为:
;故答案为: 。
。


科目:高中化学 来源: 题型:
【题目】石墨烯是目前科技研究的热点,可看作将石墨的层状结构一层一层的剥开得到的单层碳原子(结构如图所示);将氢气加入到石墨烯中开发出一种具有突破性的新材料石墨烷,下列说法中正确的是( )
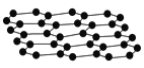
A.石墨烯是高分子化合物
B.12 g的石墨烯中含有3NA个C-C键
C.一定条件下石墨烯可与H2发生加成反应
D.根据结构示意图可知,石墨烯不能导电
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向500mL NaOH溶液中投入10.8g Al,二者恰好完全反应,计算:
(1)Al的物质的量__________。
(2)参加反应的NaOH的物质的量__________和NaOH溶液的物质的量浓度___________。
(3)生成的H2在标准状况下的体积____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含n mol AlCl3的溶液中加入m mol NaOH溶液,观察到的现象是先有白色沉淀生成,后部分溶解,则生成Al(OH)3沉淀的物质的量是( )
A.(4n-m)molB.(4m-n)molC.(n-3m)molD.(3m-n)mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现取三份各100mL溶液进行如下实验:
第一份加入AgNO3溶液有沉淀产生。第二份加足量NaOH溶液加热后,收集到0.08mol气体。第三份加足量BaCl2溶液后,得到干燥沉淀12.54g,经足量盐酸洗涤、干燥后,沉淀质量为4.66g。
根据上述实验,回答以下问题:
(1)由第一份进行的实验推断该混合物是否一定含有Cl-。__。
(2)由第二份进行的实验得知混合物中应含有__,其物质的量浓度为__。
(3)由第三份进行的实验可知12.54g沉淀的成分及物质的量是__。
(4)综合上述实验,你认为以下结论正确的是__。
A.该混合液中一定含有K+、NH4+![]() 、CO32-、SO42-,可能含Cl-,且n(K+)≥0.04mol
、CO32-、SO42-,可能含Cl-,且n(K+)≥0.04mol
B.该混合液中一定含有NH4+、CO32-、SO42-,可能含K+、Cl-
C.该混合液中一定含有NH4+、CO32-、SO42-,可能含Mg2+、K+、Cl-
D.该混合液中一定含有NH4+、SO42-,可能含Mg2+、K+、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】低碳经济成为人们一种新的生活理念,二氧化碳的捕捉和利用是能源领域的一个重要研究方向。请你结合下列有关图示和所学知识回答:
(1)用CO2催化加氢可以制取乙烯:CO2(g)+3H2(g)![]() C2H4(g)+2H2O(g)。若该反应体系的能量随反应过程变化关系如图所示,则该反应的ΔH=___(用含a、b的式子表示)。又知:相关化学键的键能如下表所示,实验测得上述反应的ΔH=-152kJ·mol-1,则表中的x=___。
C2H4(g)+2H2O(g)。若该反应体系的能量随反应过程变化关系如图所示,则该反应的ΔH=___(用含a、b的式子表示)。又知:相关化学键的键能如下表所示,实验测得上述反应的ΔH=-152kJ·mol-1,则表中的x=___。

化学键 | C=O | H—H | C=C | C—H | H—O |
键能/kJ·mol-1 | 803 | 436 | x | 414 | 464 |
(2)键能是将1mol理想气体分子AB拆开为中性气态原子A和B所需的能量。已知下列化学键的键能如下表:
化学键 | N≡N | O | N—N | N—H | O—H |
946 | 497 | 193 | 391 | 463 |
写出1mol气态肼(H2N—NH2)燃烧生成氮气和水蒸气的热化学方程式:___。
(3)二氧化碳的捕集、利用是我国能源领域的一个重要战略方向。
①科学家提出由CO2制取C的太阳能工艺如图所示。
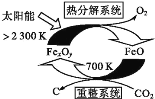
若“重整系统”发生的反应中![]() =6,则FexOy的化学式为___。“热分解系统”中每分解1molFexOy,转移电子的物质的量为___。
=6,则FexOy的化学式为___。“热分解系统”中每分解1molFexOy,转移电子的物质的量为___。
②工业上用CO2和H2反应合成二甲醚。已知:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH1=-53.7kJ·mol-1,CH3OCH3(g)+H2O(g)=2CH3OH(g) ΔH2=+23.4kJ·mol-1,则2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g) ΔH3=___kJ·mol-1。
CH3OCH3(g)+3H2O(g) ΔH3=___kJ·mol-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)真空碳热还原-氧化法可实现由铝矿制备金属铝,其相关的热化学方程式如下:
Al2O3(s)+AlCl3(g)+3C(s)═3AlCl(g)+3CO(g) △H=akJ·mol-1
3AlCl(g)═2Al(l)+AlCl3(g) △H=bkJ·mol-1
反应Al2O3(s)+3C(s)═2Al(l)+3CO(g)的△H=________kJ·mol-1(用含a、b的代数式表示);
(2)已知 2SO2(g)+O2(g)=2SO3(g)△H反应过程的能量变化如图所示,已知1mol SO2(g)氧化为1mol SO3放出99kJ的热量,请回答下列问题:
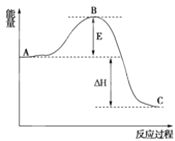
①图中A分别表示______________;
②E的大小对该反应的反应热_________(填“有”或“无”)影响;
③该反应通常用V2O5作催化剂,加V2O5会使图中B点 __________(填“升高”“降低”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
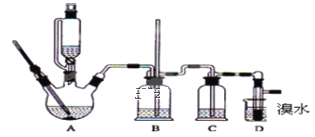
【题目】实验室用少量的溴水和足量的乙烯制备1,2-二溴乙烷的装置如图所示:
有关数据列表如下:
乙醇 | 1,2-二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/gcm-3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -l30 | 9 | -1l6 |
回答下列问题:
(1)烧瓶A中发生的主要的反应方程式:___________________________________。
(2)安全瓶B可以防倒吸,并可以检查实验进行时试管D是否发生堵塞.请写出发生堵塞时瓶B中的现象:______________________________________________________。
(3)在装置C中应加入_____(填字母),(a.水 b.浓硫酸 c.氢氧化钠溶液)其目的是 ___________________________________________________________________。
(4)若产物中有少量副产物乙醚,可用 ________________ 的方法除去。
(5)反应过程中应用冷水冷却装置D,但又不能过度冷却(如用冰水),其原因是 _________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按如图所示装置进行下列不同的操作,请回答有关问题:操作:①只接通K1;②只接通K2;③只接通K3;④都断开。
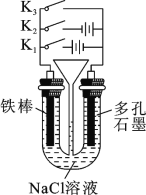
(1)铁棒的腐蚀速率由大到小的顺序是____(填操作序号)。
(2)原料粗盐中常含有泥沙和Ca2+、SO42-等杂质,必须精制后才能供电解使用。精制时,粗盐溶于水过滤后,还要加入的试剂分别为①Na2CO3、②HCl(盐酸)③BaCl2,这3种试剂添加的合理顺序是_____(填序号)。
(3)若把U形管中的NaCl溶液换成100mL0.1mol/L的CuSO4溶液,且只进行操作②,则当电路中通过0.01mol电子时:(填“铁”或“石墨”)____电极增重_____g,此时溶液的pH=_____(忽略溶液体积变化)。
(4)若把U形管中的NaCl溶液换成加入了2molAgNO3、1molNa2SO4和1molBaCl2后的溶液,且只进行操作②,则装置中可观察到的现象为:____。通电一段时间后,氧化产物与还原产物的质量比为_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com