
| A、①② | B、③④ | C、②③ | D、②④ |
| m |
| n |
| m |
| n |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
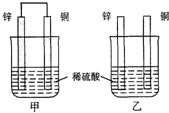 原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献.
原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献.查看答案和解析>>
科目:高中化学 来源: 题型:
 某课外活动小组用如图装置进行实验,试回答下列问题.
某课外活动小组用如图装置进行实验,试回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③⑤⑥ | B、②③④⑤⑥ |
| C、②③④⑥⑦ | D、②③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、
| ||
B、
| ||
C、
| ||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、N2、H2、NH3的百分含量相等 |
| B、3v(N2)正=v(H2)逆 |
| C、定容容器中,气体的密度不变 |
| D、N2、H2、NH3的浓度之比为1:3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Y的最高价氧化物对应的水化物一定是碱 |
| B、稳定性:W的氢化物>Z的氢化物,沸点:W的氢化物<Z的氢化物 |
| C、若X、Y、W形成的化合物为XYW2,则其水溶液显酸性 |
| D、X、Y的氧化物晶体类型不一定相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、四种溶液的pH的大小顺序:①>④>③>② |
| B、将溶液①、②等体积混合所得碱性溶液中:c(NH4+)<c(NH3?H2O) |
| C、向溶液①、②中分别滴加25mL 0.1mol/L盐酸后,溶液中c(NH4+):①>② |
| D、将溶液③、④等体积混合所得溶液中:2 c(OH-)-2c(H+)=3c(H2CO3)+c(HCO3-)-c(CO32-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com