
| A、Y的最高价氧化物对应的水化物一定是碱 |
| B、稳定性:W的氢化物>Z的氢化物,沸点:W的氢化物<Z的氢化物 |
| C、若X、Y、W形成的化合物为XYW2,则其水溶液显酸性 |
| D、X、Y的氧化物晶体类型不一定相同 |


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、③④ | C、②③ | D、②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1.5mol/(L?min) |
| B、0.15mol/(L?min) |
| C、0.75mol/(L?min) |
| D、0.075mol/(L?min) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=7的氨水和氯化铵混合溶液中c(NH4+)=c(Cl-) |
B、浓度均为0.1mol?L-1的 溶液和CH3COONa溶液中,溶液中c( 溶液和CH3COONa溶液中,溶液中c( )<c(CH3COO-) )<c(CH3COO-) |
| C、pH=3的硫酸溶液和pH=11的氨水溶液等体积混合,混合后溶液显碱性 |
| D、已知酸性HF>CH3COOH,则等体积等物质的量浓度的NaF和CH3COONa溶液所含的阴离子数后者较多 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、CO2+3H2
| |||
B、6CO2+6H2O
| |||
C、CO2+CH4
| |||
D、2CO2+6H2
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cl2+2NaOH═NaCl+NaClO+H2O |
| B、NH3+HCl═NH4Cl |
| C、Br2+2KI═I2+2KBr |
| D、CO2+Ca(OH)2═CaCO3+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
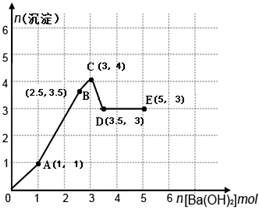 向物质的量各有1mol的NH4Al(SO4)2和H2SO4混合稀溶液中逐滴加入一定量Ba(OH)2溶液,产生沉淀的量随着Ba(OH)2加入量的变化如图所示.下列离子方程式书写正确的是( )
向物质的量各有1mol的NH4Al(SO4)2和H2SO4混合稀溶液中逐滴加入一定量Ba(OH)2溶液,产生沉淀的量随着Ba(OH)2加入量的变化如图所示.下列离子方程式书写正确的是( )| A、O→A:H++SO42-+Ba2++OH-→BaSO4↓+H2O |
| B、A→B:2Al3++3SO42-+3Ba2++6OH-→3BaSO4↓+2Al(OH)3↓ |
| C、B→C:2NH4++SO42-+Ba2++2OH-→BaSO4↓+2NH3?H2O |
| D、D→E:NH4++OH-→NH3?H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com