
【题目】化学反应中通常伴随着能量变化,下列说法中错误的是( )
A. 煤燃烧时将部分化学能转化为热能B. 电解熔融Al2O3时将部分化学能转化为电能
C. 炸药爆炸时将部分化学能转化为动能D. 镁条燃烧时将部分化学能转化为光能
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:
【题目】漂白粉在工业上有着重要的应用,某同学利用下列仪器在实验室进行制备漂白粉的实验。请回答下列问题:
I.氯气的制备
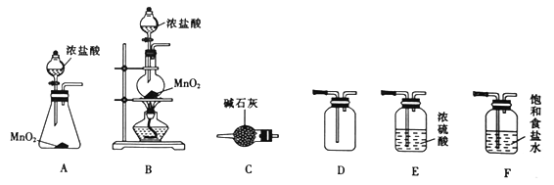
(1)装置C的名称为_______________。
(2)实验室选择上图中的装置制备并收集干燥氯气,其连接顺序为_______________(填字母)。
(3)装置F的作用为___________________________。
Ⅱ.漂白粉的制备
(4)已知:氯气和石灰乳在反应的过程中会放热,当温度较高时会生成Ca(ClO3)2。为了制得纯度较高的漂白粉并提高产率,实验中可采取的措施有__________________、____________________(不改变石灰乳的浓度和体积)。
(5)若将100 mL 12.0 molL-1盐酸与3.48 g MnO2反应制得的氯气全部通入足量的石灰乳中,理论上最多可制得Ca(ClO)2_________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于Zn+H2SO4→ZnSO4+H2↑+Q的化学反应,下列叙述不正确的是
A.反应过程中能量关系如图所示
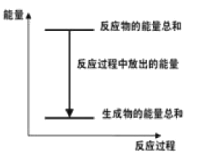
B.Q的值与反应的计量系数有关
C.若将反应设计成原电池锌为负极
D.若将其设计为原电池,当有32.5g锌溶解,正极放出的气体一定为11.2L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲酸(C6 H 5COOH)是一种重要的化工原料,广泛应用于制药和化工行业。某化学小组用甲苯作主要原料制备苯甲酸的步骤如下:
步骤一:在如图甲所示装置的三颈瓶中加入2.7mL甲苯(2.3g)、100mL水和2~3片碎瓷片,开动电动搅拌器,a中通入流动的水,在石棉网上加热至沸腾,然后分批加人8.5g高锰酸钾,在100℃时,继续搅拌约4~5h,再停止反应。

步骤二:将反应后的混合液过滤,滤液用浓盐酸酸化后用图乙所示的装置抽滤得粗产品。
步骤三:将粗产品进行重结晶即得纯品苯甲酸。
甲苯、苯甲酸钾、苯甲酸的部分物理性质见下表:

(1)仪器A的名称为___________,其出水口是___________(填“a”或“b”)。
(2)步骤一中,应在三颈瓶中观察到_________________________________的现象时才停正反应。
(3)反应结束时,测得三颈瓶中混合液为碱性,则三颈瓶内发生反应的化学方程式为_________________________________(在本实验条件下,高锰酸钾的还原产物是MnO2)
(4)步骤二中抽滤的优点是____________________________________________。
(5)如图乙所示抽滤完毕时,应先断开______________________之间的橡皮管。
(6)步骤二中,如果滤液呈紫色,要先加KHSO3,原因是______________________。
(7)若提纯得到2.9g苯甲酸,则甲酸的产率是___________%。(保留到小数点后一位)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】市售“家用消毒液发生器”是以精盐和自来水为原料,通过时发生器内的电极板上产生大量气泡(同时使产生的气体充分与电解液接触),所制得的混合液具有强烈的杀菌能力,且不致对人体造成伤害,该发生器配制消毒液所涉及到的化学反应有
(1)2NaCl+2H2O ![]() 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑
(2)Cl2+2NaOH→NaCl+NaClO+H2O
(3)H2+Cl2 ![]() 2HCl
2HCl
(4)Cl2+H2O→HCl+HClO
(5)2HClO ![]() 2HCl+O2↑
2HCl+O2↑
A.(1)(4)(5)B.(1)(2)
C.(3)(4)(5)D.(2)(3)(4)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钛及其化合物被广泛应用于飞机、火箭、导弹、人造卫星、宇宙飞船、舰艇、军工、医疗以及石油化工等领域,人们称钛为“21世纪金属”。自然界中钛的一种存在形式为金红石(主要成分是TiO2)。回答下列问题:
(1)基态钛原子的价电子排布式为__________________,与钛同周期的元素中,基态原子的未成对电子数与钛相同的元素分别是_________________(填元素符号)。
(2)钛的硬度大于铝,其原因是_________________________。
(3)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得。
①TiCl4熔点为-24℃,沸点为136.4℃,室温下为无色液体,可溶于甲苯和氯代烃,固态TiCl4属于___________晶体。
②LiBH4由Li+和BH4-构成,BH4-的空间构型是______,B原子的杂化轨道类型是___________。
(4)用锌还原TiCl4的盐酸溶液,经后续处理可制得绿色的晶体[TiCl(H2O)5]Cl2·H2O。该晶体所含元素中,电负性最大的元素是___________,与Ti形成配位键的配体是___________,1mol该配合物中含有σ键的数目为___________。
(5)TiO2晶胞是典型的四方系结构,其晶胞结构如图所示(晶胞中相同位置的原子相同),其中A、B、C的原子坐标分别为A(0,0,0)、B(0.69a,0.69a,c)、C(a,a,c),则D的原子坐标为D(0.19a,_____,______),钛氧键的键长d=___________(用代数式表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某“84”消毒液瓶体部分标签如图所示,该“84 消毒液通常稀释100 倍(体积之比)后使用。请回答下列问题:

(1)“84消毒液的物质的量浓度约为_______(保留一位小数molL-1)
(2)某同学取20mL该“84"消毒液,稀释后用于消毒,稀释后的溶液中c(Na+)=______mol
(3)“84”消毒液与稀硫酸混合使用可增强消毒能力,某消毒小组人员用98%(密度为1.8gcm-3)的浓硫酸配制1L3.6mo1L-1稀硫酸用于增强“84”消毒液的消毒能力。需用浓硫酸的体积为______mL;配制该溶液需要的仪器有玻璃棒、烧杯、量筒和_______(填玻璃仪器名称)
(4)若配制3.6mol/L的硫酸溶液的其他操作均正确,但出现下列错误操作,将使 所配制的硫酸溶液浓度偏低的是_______(填字母代号,多选题,少选不给分)
A.将稀释的硫酸溶液转移至容量瓶后,未洗涤烧杯和玻璃棒
B.稀释过程中,溶液未经冷却就转移至容量瓶
C.所用浓硫酸长时间放置在密封不好的容器中
D.用胶头滴管向容量瓶中加水时,俯视观察溶液凹液面与容量瓶刻度相切
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温时,CH3COOH的电离平衡常数为K,向20mL 0.1mol/L CH3COOH溶液中逐滴加入0.1mol/L NaOH溶液,其pH变化曲线如图所示(忽略温度变化)。下列说法中正确的是( )

A. b点表示的溶液中c(Na+)>c(CH3COO﹣)
B. c点表示CH3COOH和NaOH恰好反应完全
C. d点表示的溶液中c(CH3COO﹣) c(H+)/c(CH3COOH)大于K
D. b、c、d三点表示的溶液中一定都存在:c(Na+)+c(H+)═c(CH3COO﹣)+c(OH﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常用盐酸的质量分数为36.5%,密度为1.20 g·mL-1。
(1)此浓盐酸中HCl的物质的量浓度是________。
(2)配制100 mL该浓盐酸,需要标准状况下HCl的体积为________。
(3)配制100 mL 3.00 mol·L-1的盐酸,需以上浓盐酸的体积为________。
(4)将10.0 mL 3.00 mol·L-1的盐酸与10.0 mL 1.00 mol·L-1的MgCl2溶液混合,则混合溶液中Cl-的物质的量浓度是________。(设混合后溶液的体积不变)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com