
【题目】已知某“84”消毒液瓶体部分标签如图所示,该“84 消毒液通常稀释100 倍(体积之比)后使用。请回答下列问题:

(1)“84消毒液的物质的量浓度约为_______(保留一位小数molL-1)
(2)某同学取20mL该“84"消毒液,稀释后用于消毒,稀释后的溶液中c(Na+)=______mol
(3)“84”消毒液与稀硫酸混合使用可增强消毒能力,某消毒小组人员用98%(密度为1.8gcm-3)的浓硫酸配制1L3.6mo1L-1稀硫酸用于增强“84”消毒液的消毒能力。需用浓硫酸的体积为______mL;配制该溶液需要的仪器有玻璃棒、烧杯、量筒和_______(填玻璃仪器名称)
(4)若配制3.6mol/L的硫酸溶液的其他操作均正确,但出现下列错误操作,将使 所配制的硫酸溶液浓度偏低的是_______(填字母代号,多选题,少选不给分)
A.将稀释的硫酸溶液转移至容量瓶后,未洗涤烧杯和玻璃棒
B.稀释过程中,溶液未经冷却就转移至容量瓶
C.所用浓硫酸长时间放置在密封不好的容器中
D.用胶头滴管向容量瓶中加水时,俯视观察溶液凹液面与容量瓶刻度相切
【答案】4.0molL-1 0.04molL-1 200 胶头滴管、1000mL容量瓶 AC
【解析】
(1)根据c=![]() 计算;
计算;
(2)根据稀释前后溶液中NaClO的物质的量不变计算;
(3)根据c=![]() 计算出浓硫酸的浓度,配制过程中硫酸的物质的量不变,根据V=
计算出浓硫酸的浓度,配制过程中硫酸的物质的量不变,根据V=![]() 计算出需要浓硫酸的体积;结合溶液配制的操作分析所需要的玻璃仪器;
计算出需要浓硫酸的体积;结合溶液配制的操作分析所需要的玻璃仪器;
(4)根据c=![]() =
=![]() 分析误差。
分析误差。
(1)由c=![]() 可知,c(NaClO)=
可知,c(NaClO)=![]() mol/L=4.0molL-1;
mol/L=4.0molL-1;
(2)稀释前后溶液中NaClO的物质的量不变,则有:20 mL×10-3LmL-1×4.0molL-1=20 mL×100×10-3 LmL-1×c(NaClO),解得稀释后c(NaClO)=0.04 molL-1,c(Na+)=c(NaClO)=0.04molL-1;
(3)98%(密度为1.84gcm-3)的浓硫酸浓度为:![]() =
=![]() mol/L=18mol/L,配制1L3.6molL-1稀硫酸需用浓硫酸的体积为:
mol/L=18mol/L,配制1L3.6molL-1稀硫酸需用浓硫酸的体积为:![]() =0.2L=200mL;结合溶液配制的操作步骤,配制稀硫酸时,需要的玻璃仪器有玻璃棒、烧杯、量筒、胶头滴管、1000mL 容量瓶,故还需要的玻璃仪器是胶头滴管、1000mL 容量瓶;
=0.2L=200mL;结合溶液配制的操作步骤,配制稀硫酸时,需要的玻璃仪器有玻璃棒、烧杯、量筒、胶头滴管、1000mL 容量瓶,故还需要的玻璃仪器是胶头滴管、1000mL 容量瓶;
(4)A.将稀释的硫酸溶液转移至容量瓶后,未洗涤烧杯和玻璃棒,溶质损失,溶液浓度偏低,故A正确;
B.将稀释的硫酸溶液未冷却就转移至容量瓶中,并定容,热的溶液体积大,冷却后溶液体积减小,溶液浓度偏高,故B错误;
C.所用浓硫酸长时间放置在密封不好的容器中,因吸水性,导致浓硫酸的浓度降低,则最终所配制溶液浓度偏低,故C正确;
D.用胶头滴管向容量瓶中加水时,俯视观察溶液凹液面与容量瓶刻度相切,溶液体积偏少,导致所配制溶液浓度偏高,故D错误;
故答案为:AC。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】同温同压下,11.2L CH4与H2的混合气体恰好与11.2L O2完全反应生成CO2和H2O,则原混合气体中的平均相对分子质量为( )
A. 5.56B. 6.67C. 11.12D. 9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸汞和碘化钾溶液混合后会生成红色的碘化汞沉淀,为了探究硝酸汞和碘化钾溶液之间能否发生氧化还原反应,研究人员设计了如图的实验装置,结果电流计指针发生了偏转,下列分析不正确的是
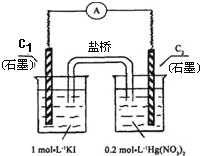
A. 如图装置的电流方向是从C2到C1
B. C1附近加入淀粉变蓝,C2析出固体
C. 可用饱和KI溶液—琼脂填充盐桥增强导电性
D. 该装置内发生的氧化还原反应可自发进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应中通常伴随着能量变化,下列说法中错误的是( )
A. 煤燃烧时将部分化学能转化为热能B. 电解熔融Al2O3时将部分化学能转化为电能
C. 炸药爆炸时将部分化学能转化为动能D. 镁条燃烧时将部分化学能转化为光能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于平衡体系mA(g)+nB(g)![]() pC(g)+qD(g) ΔH<0,下列结论中不正确的是
pC(g)+qD(g) ΔH<0,下列结论中不正确的是
A. 若温度不变,将容器的体积缩小到原来的一半,此时A的浓度为原来的2.1倍,则m+n<p+q
B. 若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m∶n
C. 若m+n=p+q,则往含有a mol气体的平衡体系中再加入a mol的B,达到新平衡时,气体的总物质的量等于2a mol
D. 若温度不变时,在恒容条件下充入稀有气体增大压强,该反应速率加快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置进行相应实验,能达到实验目的是( )
A. 用 所示装置分离CCl4和I2的混合物
所示装置分离CCl4和I2的混合物
B. 用 所示装置获取少量SO2气体
所示装置获取少量SO2气体
C. 用 所示装置除去CO2气体中的少量SO2
所示装置除去CO2气体中的少量SO2
D. 用 所示装置蒸发NaCl溶液获得NaCl晶体
所示装置蒸发NaCl溶液获得NaCl晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列叙述正确的是( )
A. 常温常压下,11.2L二氧化硫所含的氧原子数等于NA
B. 0.5molH2O所含的电子数为9NA
C. 8.0gCu2S和CuO的混合物中含有铜原子数为0.1NA
D. 300mL2mol·L-1蔗糖溶液中所含分子数为0.6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)质量比为16∶7∶6的三种气体SO2、CO、NO,分子个数之比为_____________;氧原子个数之比为____________。
(2)在标准状况下,6.8g PH3与标准状况下_______L CH4含有相同数目的H原子。
(3)某气体氧化物化学式为RO2,在标准状况下,1.28 g该氧化物的体积为448 mL,则该氧化物的摩尔质量为________,R的相对原子质量为________。
(4)273 K、1.01×105 Pa时气态单质X2的密度为1.25 g·L-1,则X的相对原子质量为________
(5)相同温度和压强条件下,一定体积的气态氢化物H2R的质量是等体积NH3的2倍,则R的相对原子质量为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com