
【题目】A、B、C、D、E都是短周期元素,原子序数依次增大,B、C同周期,A、D同主族。A、B能形成两种常温下的液态化合物甲和乙,原子个数比分别为2∶1和1∶1。根据以上信息回答下列问题:
(1)甲、乙两分子中含有非极性共价键的物质的电子式是________,C元素在周期表中的位置是_____。
(2)C和D的离子中,半径较小的是____(离子符号),以上元素中电负性最大的是____(元素符号)
(3)常温下将D的单质投入甲中,待D消失后再向上述溶液中加入E的固体单质,此时发生反应的化学方程式是______________。
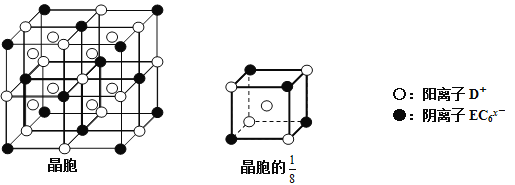
(4)C、D、E可组成离子化合物DxEC6,其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如下图所示,阳离子D+(用○表示)位于正方体的棱的中点和正方体内部;阴离子EC6x-(用●表示)位于该正方体的顶点和面心。该化合物的化学式是_________。
【答案】![]() 第二周期、第ⅦA族 Na+ F 2Al+2NaOH+2H2O=2NaAlO2+3H2↑ Na3AlF6
第二周期、第ⅦA族 Na+ F 2Al+2NaOH+2H2O=2NaAlO2+3H2↑ Na3AlF6
【解析】
A、B、C、D、E都是短周期主族元素,原子序数依次增大,A、B能形成两种液态化合物甲和乙,原子个数比分别为2:1和1:1,则A为H元素,B为O元素,甲为H2O、乙为H2O2;A、D同主族,则D为Na元素;B、C同周期,则C为F元素;结合(3)Al与碱反应,则E为Al元素。
(1)甲为H2O,含极性键的极性分子,乙为H2O2,含极性键、非极性键的极性分子,则H2O2的电子式为:![]() ;C为F元素,位于第二周期VIIA,故答案为:
;C为F元素,位于第二周期VIIA,故答案为:![]() ;第二周期VIIA;
;第二周期VIIA;
(2)C为F元素、D为Na元素,F-与Na+的核外电子层结构相同,原子序数大的离子半径小,故半径较小的是Na+;同周期,从左到右,电负性增大,同主族,从上到下,电负性减小,则电负性最大的是F,故答案为:Na+;F;
(3)D为Na元素,E为Al元素,甲为H2O,Na与水反应生成NaOH和H2,加入Al的固体单质,Al与NaOH反应生成偏铝酸钠和氢气,其化学反应方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(4)C、D、E分别为F、Na和Al,组成离子化合物NaxAlF6,该晶胞的![]() 中含有的Na+个数为1+4×
中含有的Na+个数为1+4×![]() =
=![]() ,阴离子AlF6x-个数为4×
,阴离子AlF6x-个数为4×![]() =
=![]() ,所以其化学式中阴阳离子个数之比为1:3,化学式为Na3AlF6,故答案为:Na3AlF6。
,所以其化学式中阴阳离子个数之比为1:3,化学式为Na3AlF6,故答案为:Na3AlF6。


科目:高中化学 来源: 题型:
【题目】室温下,下列溶液中微粒的物质的量浓度关系正确的是
A.CH3COONa和CH3COOH混合溶液[pH=7,c(Na+)=0.1 mol·L1]:c(Na+)=c(CH3COO)>c(CH3COOH)>c(H+)=c(OH)
B.20 mL 0.1 mol·L1 CH3COONa溶液中加入0.1 mol·L1盐酸至溶液pH=7:c(CH3COOH)=c(Cl)
C.0.1 mol·L1 CH3COOH溶液与0.1 mol·L1 Na2CO3溶液等体积混合(无气体逸出):c(![]() )>c(CH3COOH)+c(H2CO3)
)>c(CH3COOH)+c(H2CO3)
D.0.4 mol·L1 CH3COOH溶液和0.2 mol·L1 NaOH溶液等体积混合(pH<7):c(CH3COOH)>c(CH3COO)>c(Na+)>c(H+)>c(OH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】除去下列物质中含有的少量杂质(括号中的物质)的方法中错误的是( )
A.H2(HCl):通过水洗涤再干燥
B.NO(NO2):通过水洗涤再干燥
C.Na2CO3固体(NaHCO3):加热混合物
D.Fe2+溶液(Fe3+):加入Cu片
查看答案和解析>>
科目:高中化学 来源: 题型:
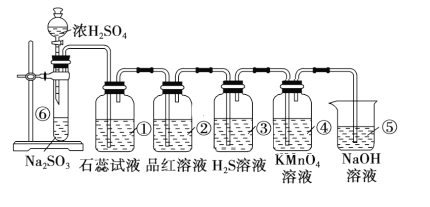
【题目】如图是实验室制取SO2并验证SO2某些性质的装置图。已知SO2具有:A.酸性、B.氧化性、C.还原性、D.漂白性。
试回答:
(1)①中的现象为__,证明SO2具有__性(请填字母);
(2)②中的品红溶液__,证明SO2有__性(请填字母);
(3)④中的现象是__,证明SO2有__性(请填字母);
(4)⑤的作用是___,试写出该反应的离子反应方程式__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平;②2RCHO+O2![]() 2RCOOH。现以A为主要原料合成乙酸乙酯,其合成路线如图1所示。
2RCOOH。现以A为主要原料合成乙酸乙酯,其合成路线如图1所示。
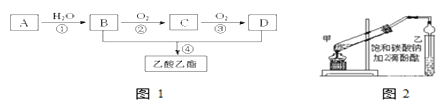
(1)B、D分子内含有的官能团分别是____、______(填名称)。
(2)写出下列反应的反应类型:①______,④________。
(3)B→C的反应方程式为____________
(4)乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业。实验室制取的主要步骤如下:
①在甲试管(如图2)中加入2mL浓硫酸、3mL乙醇和2mL乙酸的混合溶液。
②按如图连接好装置(装置气密性良好)并加入混合液,用小火均匀地加热3~5min。
③待试管乙收集到一定量产物后停止加热,撤出试管并用力振荡,然后静置待分层。
④分离出有机层、洗涤、干燥。
a.若实验中用乙酸和含18O的乙醇作用,该反应的化学方程式是:______,此装置中采用了球形干燥管,其作用是_________。
b.欲将乙试管中的物质分离开以得到乙酸乙酯,必须使用的仪器是_____;分离时,乙酸乙酯应该从仪器____(填:“下口放” 或“上口倒”)出。
c.生成乙酸乙酯的反应是可逆反应,反应一段时间后,下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有(填序号)______。
①混合物中各物质的浓度不再变化;
②单位时间里,生成1mol乙醇,同时生成1mol乙酸;
③单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜镁合金2.14 g完全溶于一定浓度的硝酸,硝酸被还原成NO2、NO、N2O三种气体且标准况下它们体积均为0.224 L。反应后的溶液中加入足量氢氧化钠溶液,生成的沉淀经过滤、洗涤、干燥后称量,质量为
A.3.12 gB.4.68 gC.5.08 gD.4.18 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实,不能用勒夏特列原理解释的是( )
A.氨水中加酸,NH4+的浓度增大
B.合成氨工业中不断从反应混合物中液化分离出氨气
C.实验室中常用排饱和食盐水的方法收集Cl2
D.合成氨控制在500℃左右的温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯度单晶硅是典型的无机非金属材料,又称“半导体”材料,它的发现和使用曾引起计算机的一场“革命”。这种材料可以按下列方法制备:
SiO2![]() Si(粗)
Si(粗)![]() SiHCl3
SiHCl3![]() Si(纯)
Si(纯)
(1)写出步骤①的化学方程式:___。
(2)步骤②经过冷凝得到的SiHCl3(沸点为33.0℃)中含有少量的SiCl4(沸点为57.6℃)和HCl(沸点为-84.7℃),提纯SiHCl3的主要化学操作的名称是___;SiHCl3和SiCl4一样遇水可发生剧烈水解,已知SiHCl3水解会生成两种气态产物,请写出其水解的化学方程式:___。
(3)请写出二氧化硅与氢氟酸反应的化学方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H是一种药物合成中间体,其合成路线如下:
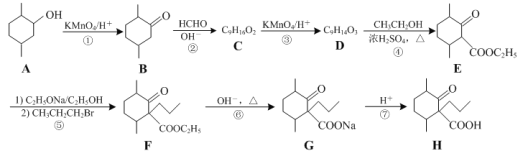
(1)A→B的反应的类型是____反应。
(2)化合物H中所含官能团的名称是______。
(3)化合物C的结构简式为____。B→C反应时会生成一种与C互为同分异构体的副产物,该副产物的结构简式为____。
(4)D的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:____。
①能发生水解反应,所得两种水解产物均含有3种化学环境不同的氢;
②分子中含有六元环,能使溴的四氯化碳溶液褪色。
(5)已知:![]()
![]() CH2ClCH2OH。写出以环氧乙烷(
CH2ClCH2OH。写出以环氧乙烷(![]() )、
)、![]() 、乙醇和乙醇钠为原料制备
、乙醇和乙醇钠为原料制备 的合成路线流程图____。(无机试剂任用,合成路线流程图示例见本题题干)
的合成路线流程图____。(无机试剂任用,合成路线流程图示例见本题题干)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com