
【题目】高纯度单晶硅是典型的无机非金属材料,又称“半导体”材料,它的发现和使用曾引起计算机的一场“革命”。这种材料可以按下列方法制备:
SiO2![]() Si(粗)
Si(粗)![]() SiHCl3
SiHCl3![]() Si(纯)
Si(纯)
(1)写出步骤①的化学方程式:___。
(2)步骤②经过冷凝得到的SiHCl3(沸点为33.0℃)中含有少量的SiCl4(沸点为57.6℃)和HCl(沸点为-84.7℃),提纯SiHCl3的主要化学操作的名称是___;SiHCl3和SiCl4一样遇水可发生剧烈水解,已知SiHCl3水解会生成两种气态产物,请写出其水解的化学方程式:___。
(3)请写出二氧化硅与氢氟酸反应的化学方程式:___。
【答案】SiO2+2C ![]() Si+2CO↑ 蒸馏或分馏 SiHCl3+3H2O═H2SiO3+H2↑+3HCl↑ SiO2+4HF═SiF4↑+2H2O
Si+2CO↑ 蒸馏或分馏 SiHCl3+3H2O═H2SiO3+H2↑+3HCl↑ SiO2+4HF═SiF4↑+2H2O
【解析】
(1)焦炭在高温下可以置换二氧化硅中的硅;
(2)根据熔沸点的不同实现物质分离的方法为蒸馏或分馏;SiHCl3水解生成硅酸、氢气和氯化氢;
(3)二氧化硅能和氢氟酸反应生成四氟化硅和水。
(1)工业上用焦炭在高温下置换二氧化硅中的硅来制备粗硅,反应的化学方程式为:SiO2+2C ![]() Si+2CO↑,故答案为:SiO2+2C
Si+2CO↑,故答案为:SiO2+2C ![]() Si+2CO↑;
Si+2CO↑;
(2)由题意可知,SiHCl3(沸点33.0℃)、SiCl4(沸点57.6℃)、HCl(沸点-84.7℃)的沸点不同,根据沸点的不同实现物质分离的方法为蒸馏或分馏;SiHCl3水解生成硅酸、氢气和氯化氢,反应的化学方程式为:SiHCl3+3H2O═H2SiO3+H2↑+3HCl↑,故答案为:蒸馏或分馏;SiHCl3+3H2O═H2SiO3+H2↑+3HCl↑;
(3)二氧化硅能和氢氟酸反应生成四氟化硅和水,反应的化学方程式为:SiO2+4HF═SiF4↑+2H2O,故答案为:SiO2+4HF═SiF4↑+2H2O。


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:
【题目】莲花清瘟胶囊对新冠肺炎轻症状患者有显著疗效,其有效成分绿原酸存在如图转化关系,下列有关说法正确的是
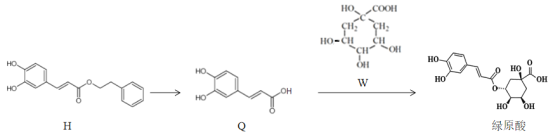
A.H的分子式为C17H14O4
B.Q中所有碳原子不可能都共面
C.1mol绿原酸与足量NaHCO3溶液反应,最多放出1molCO2
D.H、Q、W均能发生氧化反应、取代反应、显色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E都是短周期元素,原子序数依次增大,B、C同周期,A、D同主族。A、B能形成两种常温下的液态化合物甲和乙,原子个数比分别为2∶1和1∶1。根据以上信息回答下列问题:
(1)甲、乙两分子中含有非极性共价键的物质的电子式是________,C元素在周期表中的位置是_____。
(2)C和D的离子中,半径较小的是____(离子符号),以上元素中电负性最大的是____(元素符号)
(3)常温下将D的单质投入甲中,待D消失后再向上述溶液中加入E的固体单质,此时发生反应的化学方程式是______________。
(4)C、D、E可组成离子化合物DxEC6,其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如下图所示,阳离子D+(用○表示)位于正方体的棱的中点和正方体内部;阴离子EC6x-(用●表示)位于该正方体的顶点和面心。该化合物的化学式是_________。
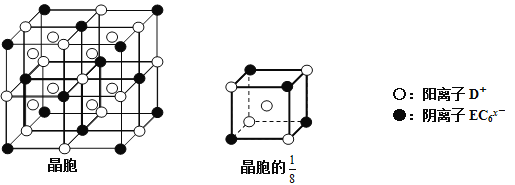
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知短周期元素的离子:aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则下列叙述正确的是( )
A. 原子半径:A>B>D>CB. 原子序数:d>c>b>a
C. 离子半径:C>D>B>AD. 单质的还原性:A>B>D>C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】普罗帕酮为广谱高效抗心律失常药,它可由有机物X经多步反应合成:
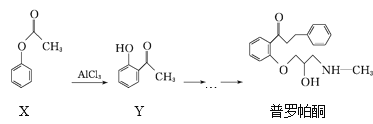
下列有关说法正确的是
A.在有机物X的1H核磁共振谱图中,有3组特征峰
B.可用溴水或FeCl3溶液鉴别X和Y
C.普罗帕酮分子中有1个手性碳原子
D.普罗帕酮能发生加成、水解、氧化、消去反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锰锌铁氧体是应用广泛的高性能磁性材料。现以akg废旧碱性锌锰电池为原料(含锰元素的物质:MnO2占b%,MnOOH占c%)制备锰锌铁氧体,主要流程如下:
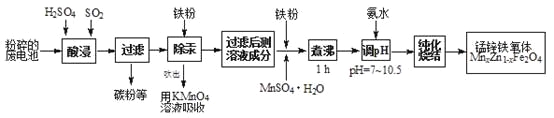
(1)酸浸废电池时,被溶解生成Zn2+的物质有______,SO2的作用是_____(填字母编号)。
A.漂白剂 | B.沉淀剂 | C.氧化剂 | D.还原剂 |
(2)除汞是以氮气为载体吹入滤液带出汞蒸汽,经KMnO4溶液吸收而实现的。如图是KMnO4溶液处于不同pH时对应的单位时间Hg去除率变化图,图中物质为Hg与MnO4-在该pH范围反应的主要产物。
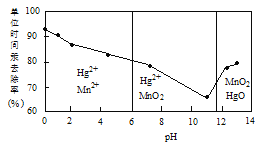
①pH<6时反应的离子方程式为___________。
②汞的去除速率随pH变化的规律是_________。
(3)锌锰干电池中MnO2可以用碳酸锰在空气中煅烧制得。
已知25℃,101 kPa时:2MnO(s)+O2(g)=2MnO2(s) H=-272.0 kJ/mol
MnCO3(s)=MnO(s)+CO2(g) H=+116.6 kJ/mol
碳酸锰在空气中煅烧反应生成MnO2的热化学方程式是_______________。
(4)x=0.2的锰锌铁氧体具有较高的饱和磁场强度,该锰锌铁氧体的组成用氧化物形式(最简整数比)表示为____________。若制得这种锰锌铁氧体的质量为100 kg,在制取过程中不考虑损耗,需补充硫酸锰晶体(MnSO4·H2O)_________kg。(只列出计算式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以葡萄糖为燃料的微生物燃料电池结构如图所示。已知总反应为C6H12O6+6O2===6CO2+6H2O,关于该电池的叙述正确的是
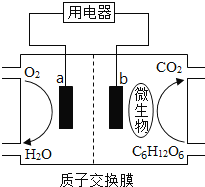
A.a电极反应:O2+2H2O+4e-===4OH-
B.O2在a电极被氧化
C.b电极反应:C6H12O6+6H2O-24e-===6CO2+24H+
D.该电池能够在高温下工作
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取氨气、收集、验证其还原性并进行尾气处理的装置和原理能达到实验目的的是
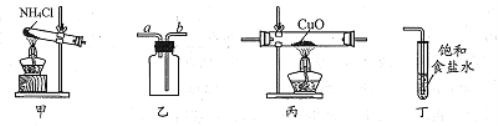
A.用装置甲制取氨气
B.用装置乙收集氨气时气体应该从a口进b口出
C.装置丙中黑色固体变成红色时还原产物一定为铜
D.可以用装置丁吸收氨气,进行尾气处理
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1molL-1HCl溶液滴定10.0mL浓度为0.1molL-1Na2CO3溶液,所得滴定曲线如图所示。下列微粒浓度大小关系正确的是
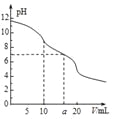
A. 当V=0时:c(H+)+c(HCO3-)+c(H2CO3)=c(OH-)
B. 当V=5时:c(CO32-)+c(HCO3-)+c(H2CO3)=2c(Cl-)
C. 当V=10时:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3)
D. 当V=a时:c(Na+)=c(Cl-)>c(H+)=c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com