
【题目】锰锌铁氧体是应用广泛的高性能磁性材料。现以akg废旧碱性锌锰电池为原料(含锰元素的物质:MnO2占b%,MnOOH占c%)制备锰锌铁氧体,主要流程如下:
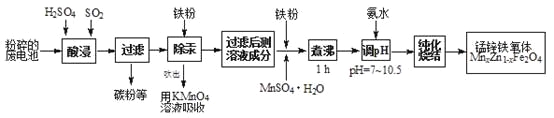
(1)酸浸废电池时,被溶解生成Zn2+的物质有______,SO2的作用是_____(填字母编号)。
A.漂白剂 | B.沉淀剂 | C.氧化剂 | D.还原剂 |
(2)除汞是以氮气为载体吹入滤液带出汞蒸汽,经KMnO4溶液吸收而实现的。如图是KMnO4溶液处于不同pH时对应的单位时间Hg去除率变化图,图中物质为Hg与MnO4-在该pH范围反应的主要产物。
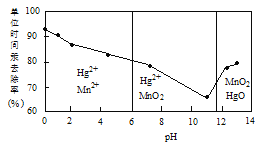
①pH<6时反应的离子方程式为___________。
②汞的去除速率随pH变化的规律是_________。
(3)锌锰干电池中MnO2可以用碳酸锰在空气中煅烧制得。
已知25℃,101 kPa时:2MnO(s)+O2(g)=2MnO2(s) H=-272.0 kJ/mol
MnCO3(s)=MnO(s)+CO2(g) H=+116.6 kJ/mol
碳酸锰在空气中煅烧反应生成MnO2的热化学方程式是_______________。
(4)x=0.2的锰锌铁氧体具有较高的饱和磁场强度,该锰锌铁氧体的组成用氧化物形式(最简整数比)表示为____________。若制得这种锰锌铁氧体的质量为100 kg,在制取过程中不考虑损耗,需补充硫酸锰晶体(MnSO4·H2O)_________kg。(只列出计算式)
【答案】Zn、Zn(OH)2 D 2MnO4-+5Hg+16H+=2Mn2++5Hg2++8H2O 随pH增大,汞的去除速率先减小后增大 2MnCO3(s)+O2(g)=2MnO2(s)+2CO2(g) H=-38.8 kJ/mol MnO·4ZnO·5Fe2O3 169×(![]() -
-![]() -
-![]() )
)
【解析】
废旧碱性锌锰电池中含有Zn、Zn(OH)2、碳粉以及MnO2和MnOOH等,加入稀硫酸、通入二氧化硫,Zn、Zn(OH)2和硫酸反应生成Zn2+,MnO2和MnOOH在酸性条件下被二氧化硫还原为Mn2+,过滤除去碳粉,滤液中加入铁粉、MnSO4·H2O,煮沸1h,再加氨水调节PH至7~10.5,纯化烧结得到锰锌铁氧体。
(1)锌锰电池中含有锌的物质有Zn、Zn(OH)2,可以与酸反应生成锌离子;SO2在此作了还原剂。
(2)①据图得pH<6时主要以Mn2+和Hg2+存在,故反应:2MnO4-+5Hg+16H+=2Mn2++5Hg2++8H2O;②据图像得随pH增大,汞的去除速率先减小后增大。
(3)已知25℃,101 kPa时:①2MnO(s)+O2(g)=2MnO2(s) H1=-272.0 kJ/mol②MnCO3(s)=MnO(s)+CO2(g) H2=+116.6 kJ/mol碳酸锰在空气中煅烧反应生成MnO2的化学方程式是2MnCO3(s)+O2(g)=2MnO2(s)+2CO2(g) H3,据盖斯定律H3=H1+2H2=-38.8 kJ/mol。
(4)x=0.2时,锰锌铁氧体的化学式为Mn0.2Zn0.8Fe2O4,化为整数关系为Mn1Zn4Fe10O20,写成氧化物形式:MnO·4ZnO·5Fe2O3;据题意aKg电池中Mn的物质的量=![]() +
+![]() ,100 kg锰锌铁氧体中Mn的物质的量为100/1195=
,100 kg锰锌铁氧体中Mn的物质的量为100/1195=![]() , 需补充硫酸锰晶体(MnSO4·H2O)物质的量=
, 需补充硫酸锰晶体(MnSO4·H2O)物质的量=![]() -(
-(![]() +
+![]() ),质量=169×(
),质量=169×(![]() -
-![]() -
-![]() ) kg。
) kg。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】有效去除大气中的NOx和SO2是环境保护的重要课题。
(1)酸性条件下,NaClO2吸收NO的相关热化学方程式如下:
4NO(g) + 3NaClO2(aq) + 2H2O(l) = 4HNO3(aq) + 3NaCl(aq) ΔH= a kJ·mol1
5NaClO2(aq) + 4HCl(aq) = 4ClO2(g) + 2H2O(l) + 5NaCl(aq) ΔH= b kJ·mol1
反应5NO(g) + 3ClO2(g) + 4H2O(l) = 5HNO3(aq) + 3HCl(aq) ΔH=________kJ·mol1。
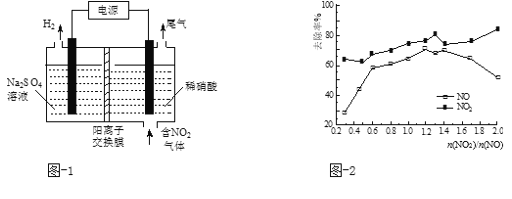
(2)用电解法处理氮氧化物可回收硝酸。实验室模拟电解NO2的装置如图-1所示。写出电解时阳极的电极反应式:________。
(3)用CO(NH2)2水溶液吸收SO2并通入O2,反应生成(NH4)2SO4和CO2。写出该反应的化学方程式:___________。
(4)利用活性焦炭的吸附作用,可以对烟气进行脱硫和脱硝。被吸附的NO2与活性焦炭反应生成N2和CO2,当生成1 mol N2时,转移的电子数为_________mol。
(5)一定条件下,将一定浓度NOx(NO2和NO的混合气体)通入0.05 mol·L1的Ca(OH)2乳浊液中,发生的反应为:3NO2 + 2OH-= NO +2NO3-+ H2O;NO + NO2 +2OH-= 2NO2- + H2O。改变![]() ,NOx的去除率见图-2。
,NOx的去除率见图-2。
①![]() 的合适范围是___________________。
的合适范围是___________________。
②当![]() 大于1.4时,NO2去除效率升高,但NO去除效率却降低。其可能的原因是______ 。
大于1.4时,NO2去除效率升高,但NO去除效率却降低。其可能的原因是______ 。
③O3和NO发生的主要反应为:NO + O3 = NO2 + O2。保持NO的初始浓度不变,改变![]() ,将反应后的混合气体通入0.05mol·L1Ca(OH)2乳浊液中吸收。为节省O3的用量,又能保持NOx去除效果,则
,将反应后的混合气体通入0.05mol·L1Ca(OH)2乳浊液中吸收。为节省O3的用量,又能保持NOx去除效果,则![]() 合适的值约为_________。
合适的值约为_________。
a.0.6 b.0.8 c.1.4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜镁合金2.14 g完全溶于一定浓度的硝酸,硝酸被还原成NO2、NO、N2O三种气体且标准况下它们体积均为0.224 L。反应后的溶液中加入足量氢氧化钠溶液,生成的沉淀经过滤、洗涤、干燥后称量,质量为
A.3.12 gB.4.68 gC.5.08 gD.4.18 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50 mL浓H2SO4溶液(足量)中加入3.2 g Cu,在加热条件下充分反应:
(1)将题干中反应后的溶液稀释到500 mL,取出50 mL,并向取出液中加入足量的BaCl2溶液,得到沉淀19.81 g,则原浓硫酸的物质的量浓度为____。
(2)若题干中浓硫酸的物质的量浓度为a mol/L,投入足量的铜片加热,充分反应后,被还原的硫酸的物质的量n(H2SO4)___0.025a mol(填“等于”、“大于”或“小于”)。
(3)反应消耗的H2SO4的物质的量是____,生成SO2的体积为(标准状况下)_____mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯度单晶硅是典型的无机非金属材料,又称“半导体”材料,它的发现和使用曾引起计算机的一场“革命”。这种材料可以按下列方法制备:
SiO2![]() Si(粗)
Si(粗)![]() SiHCl3
SiHCl3![]() Si(纯)
Si(纯)
(1)写出步骤①的化学方程式:___。
(2)步骤②经过冷凝得到的SiHCl3(沸点为33.0℃)中含有少量的SiCl4(沸点为57.6℃)和HCl(沸点为-84.7℃),提纯SiHCl3的主要化学操作的名称是___;SiHCl3和SiCl4一样遇水可发生剧烈水解,已知SiHCl3水解会生成两种气态产物,请写出其水解的化学方程式:___。
(3)请写出二氧化硅与氢氟酸反应的化学方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室模拟合成硫酸的流程如下:

从下图中选择制取气体的合适装置:

(1)装置C的名称为__________,实验室通常用装置C制备_____。
A.H2 B.C2H2 C.CO2 D.NH3
(2)实验室用装置D制备O2的化学方程式为____________________。
(3)若用装置B制备SO2,可以选用试剂为_____。
A.浓硫酸、亚硫酸钠固体 B.浓硫酸、铜片
C.稀硫酸、亚硫酸钠溶液 D.浓硫酸、铁屑
(4)SO2和O2通过甲装置,甲装置的作用除了可以控制SO2、O2的流速外,还可以__________、__________。

(5)使用乙处导出的有关气体制成硫酸,下列a、b、c三套装置中你选择的是_______,该套装置与其它装置比较,其优点是___________________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石油是工业的血液,通过它可以得到很多重要的化工产品。

已知: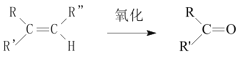 +
+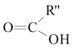
(1)B和A为同系物,B的结构简式为____,其含有的官能团名称为____。
(2)反应①的化学方程式为___,其反应类型为____。
(3)写出检验C3H5Cl中含有的Cl原子的方法____。
(4)C的结构简式为___。
(5)反应④的化学方程式为_____。
(6)设计一条由乙烯为原料制备D的合成路线(其他无机原料任选)。___
合成路线流程图示例如下:CH3CH2OH![]() CH2=CH2
CH2=CH2![]() BrH2C-CH2Br。
BrH2C-CH2Br。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国城市为了减少燃煤造成的大气污染,对于作民用燃料的煤进行了多方面的改进。
(1)为了除去煤中的含硫化合物,采用FeCl3脱硫,即用FeCl3溶液浸洗煤粉,发生如下反应:FeS2+14FeCl3+8H2O=2FeSO4+13FeCl2+16HCl。
①该反应中的氧化剂是________,若有1 mol FeS2被除去,则发生转移的电子的物质的量是________。
②为了充分利用Fe2+并减少酸(HCl)污染,本方法中可利用工业废铁屑和氯气让废液重新利用生成FeCl3。请写出这一过程中有关的离子方程式:_____________。
(2)另一种方法是采用“固硫法”,即在燃料中加入生石灰,使含硫煤在燃烧时生成的SO2不能逸出而进入炉渣中,试用化学方程式表示这一“固硫”过程:_______、________。
(3)某城市采用了以油制气代替煤作民用燃料的做法。油制气的主要成分是丙烷,请写出其燃烧的化学方程式:_____________。
(4)绿色能源是人类的理想能源,不会造成环境污染,下列能源属于绿色能源的是________。
A 氢能源 B 太阳能 C 风能 D 石油
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com