
【题目】有效去除大气中的NOx和SO2是环境保护的重要课题。
(1)酸性条件下,NaClO2吸收NO的相关热化学方程式如下:
4NO(g) + 3NaClO2(aq) + 2H2O(l) = 4HNO3(aq) + 3NaCl(aq) ΔH= a kJ·mol1
5NaClO2(aq) + 4HCl(aq) = 4ClO2(g) + 2H2O(l) + 5NaCl(aq) ΔH= b kJ·mol1
反应5NO(g) + 3ClO2(g) + 4H2O(l) = 5HNO3(aq) + 3HCl(aq) ΔH=________kJ·mol1。
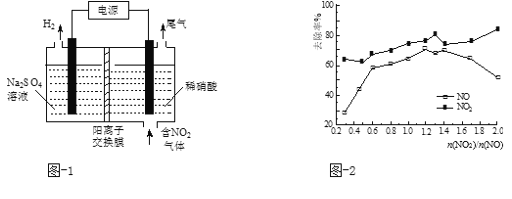
(2)用电解法处理氮氧化物可回收硝酸。实验室模拟电解NO2的装置如图-1所示。写出电解时阳极的电极反应式:________。
(3)用CO(NH2)2水溶液吸收SO2并通入O2,反应生成(NH4)2SO4和CO2。写出该反应的化学方程式:___________。
(4)利用活性焦炭的吸附作用,可以对烟气进行脱硫和脱硝。被吸附的NO2与活性焦炭反应生成N2和CO2,当生成1 mol N2时,转移的电子数为_________mol。
(5)一定条件下,将一定浓度NOx(NO2和NO的混合气体)通入0.05 mol·L1的Ca(OH)2乳浊液中,发生的反应为:3NO2 + 2OH-= NO +2NO3-+ H2O;NO + NO2 +2OH-= 2NO2- + H2O。改变![]() ,NOx的去除率见图-2。
,NOx的去除率见图-2。
①![]() 的合适范围是___________________。
的合适范围是___________________。
②当![]() 大于1.4时,NO2去除效率升高,但NO去除效率却降低。其可能的原因是______ 。
大于1.4时,NO2去除效率升高,但NO去除效率却降低。其可能的原因是______ 。
③O3和NO发生的主要反应为:NO + O3 = NO2 + O2。保持NO的初始浓度不变,改变![]() ,将反应后的混合气体通入0.05mol·L1Ca(OH)2乳浊液中吸收。为节省O3的用量,又能保持NOx去除效果,则
,将反应后的混合气体通入0.05mol·L1Ca(OH)2乳浊液中吸收。为节省O3的用量,又能保持NOx去除效果,则![]() 合适的值约为_________。
合适的值约为_________。
a.0.6 b.0.8 c.1.4
【答案】5a-3b/4 NO2 e + H2O = 2H+ + NO3 2CO(NH2)2 + 2SO2 + 4H2O + O2 = 2 (NH4)2SO4+ 2CO2 8 1.2-1.4 NO2和OH-反应生成NO3-和NO,导致NO去除率降低 a
【解析】
(1)酸性条件下,NaClO2吸收NO的相关热化学方程式如下:
①4NO(g) + 3NaClO2(aq) + 2H2O(l) = 4HNO3(aq) + 3NaCl(aq)△H=a kJmol-1
②5NaClO2(aq) + 4HCl(aq) = 4ClO2(g) + 2H2O(l) + 5NaCl(aq)△H=b kJmol-1
盖斯定律计算(①×5-②×3)×![]() 得到反应5NO(g) + 3ClO2(g) + 4H2O(l) = 5HNO3(aq) + 3HCl(aq);
得到反应5NO(g) + 3ClO2(g) + 4H2O(l) = 5HNO3(aq) + 3HCl(aq);
(2)根据图知,电解时,左室中电极上氢离子放电生成氢气,则左室为阴极室,右室为阳极室,阳极上通入的是氮氧化物,生成的硝酸,所以阳极上氮氧化物失电子和水生成硝酸;
(3)用CO(NH2)2水溶液吸收SO2并通入O2,反应生成(NH4)2SO4和CO2,结合原子守恒和电子守恒平配平书写化学方程式;
(4)被吸附的NO2与活性焦炭反应生成N2和CO2,写出化学方程式,结合方程式中的定量关系计算电子转移总数;
(5)①图象读取去除率最高时的![]() 的合适范围;
的合适范围;
②当![]() 大于1.4时,NO2去除效率升高,但NO去除效率却降低是因为二氧化氮反应生成一氧化氮;
大于1.4时,NO2去除效率升高,但NO去除效率却降低是因为二氧化氮反应生成一氧化氮;
③O3和NO发生的主要反应为:NO+O3=NO2+O2.保持NO的初始浓度不变,改变![]() ,节省O3的用量,又能保持NOx去除效果,需要保持
,节省O3的用量,又能保持NOx去除效果,需要保持![]() 的合适范围是1.2~1.4。
的合适范围是1.2~1.4。
(1)酸性条件下,NaClO2吸收NO的相关热化学方程式如下:
①4NO(g)+3NaClO2(aq)+2H2O(l)=4HNO3(aq)+3NaCl(aq)△H=akJmol1
②5NaClO2(aq)+4HCl(aq)=4ClO2(g)+2H2O(l)+5NaCl(aq)△H=bkJmol1
盖斯定律计算(①×5②×3)×![]() 得到反应5NO(g)+3ClO2(g)+4H2O(l)=5HNO3(aq)+3HCl(aq)△H=
得到反应5NO(g)+3ClO2(g)+4H2O(l)=5HNO3(aq)+3HCl(aq)△H=![]() kJ/mol,
kJ/mol,
故答案为:![]() ;
;
(2)根据图知,电解时,左室中电极上氢离子放电生成氢气,则左室为阴极室,右室为阳极室,阳极上通入的是氮氧化物,生成的硝酸,所以阳极上氮氧化物失电子和水生成硝酸,电极反应式为NO2e+H2O=NO3+2H+,
故答案为:NO2e+H2O=NO3+2H+;
(3)用CO(NH2)2水溶液吸收SO2并通入O2,反应生成(NH4)2SO4和CO2,反应的化学方程式:2CO(NH2)2+2SO2+4H2O+O2=2(NH4)2SO4+2CO2,
故答案为:2CO(NH2)2+2SO2+4H2O+O2=2(NH4)2SO4+2CO2;
(4)被吸附的NO2与活性焦炭反应生成
故答案为:8;
(5)①图中曲线变化分析可知,![]() 的合适范围是1.21.4,在此范围去除率最大,
的合适范围是1.21.4,在此范围去除率最大,
故答案为:1.21.4;
②当![]() 大于1.4时,NO2去除效率升高,但NO去除效率却降低,原因是:NO2和OH反应生成NO3和NO,导致NO去除率降低,
大于1.4时,NO2去除效率升高,但NO去除效率却降低,原因是:NO2和OH反应生成NO3和NO,导致NO去除率降低,
故答案为:NO2和OH反应生成NO3和NO,导致NO去除率降低;
③O3和NO发生的主要反应为:NO+O3=NO2+O2,保持NO的初始浓度不变,改变![]() ,节省O3的用量,又能保持NOx去除效果,需要保持
,节省O3的用量,又能保持NOx去除效果,需要保持![]() 的合适范围是1.21.4,则
的合适范围是1.21.4,则![]() 合适的值约为0.60.7,故选a,
合适的值约为0.60.7,故选a,
故答案为:a。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】碱式氯化铜[CuaClb(OH)cH2O]是一种重要的无机杀虫剂,它可以通过以下步骤制备。步骤1:将铜粉加入稀盐酸中,并持续通空气反应后生成CuCl2。已知Fe3+对该反应有催化作用,其催化原理如图所示
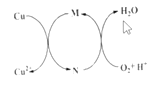
步骤2:在制得的CuCl2溶液中,加入石灰乳充分反应后即可制备碱式氯化铜。下列有关说法正确的是( )
A.a、b、c之间的关系式为:a=b+c
B.图中M、N分别为Fe2+、Fe3+
C.步骤1充分反应后,加入CuO是为了除去Fe3+
D.若制备1molCuCl2,理论上消耗11.2LO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】桶烯(Barrelene)结构简式如图所示,有关说法不正确的是
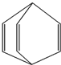
A.桶烯分子中所有的碳原子杂化类型均为sp2杂化
B.桶烯在一定条件下能发生加聚反应
C.桶烯与苯乙烯(C6H5CH=CH2)互为同分异构体
D.桶烯中的一个氢原子被氯原子取代,所得产物只有两种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。如图为![]() 和
和![]() 反应生成
反应生成![]() 过程中的能量变化,下列说法中正确的是
过程中的能量变化,下列说法中正确的是
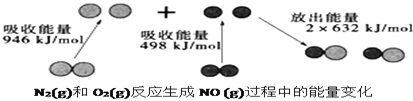
A.![]() 和
和![]() 完全反应放出的能量为180kJ
完全反应放出的能量为180kJ
B.通常情况下,![]() 和
和![]() 混合能直接生成NO
混合能直接生成NO
C.![]() 和
和![]() 具有的总能量小于
具有的总能量小于![]() 具有的总能量
具有的总能量
D.NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】莲花清瘟胶囊对新冠肺炎轻症状患者有显著疗效,其有效成分绿原酸存在如图转化关系,下列有关说法正确的是
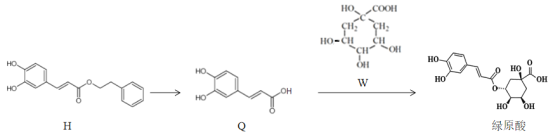
A.H的分子式为C17H14O4
B.Q中所有碳原子不可能都共面
C.1mol绿原酸与足量NaHCO3溶液反应,最多放出1molCO2
D.H、Q、W均能发生氧化反应、取代反应、显色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为实现随处可上网,中国发射了“中星16号”卫星。NH4ClO4是火箭的固体燃料,发生反应为2NH4ClO4 ![]() N2↑+Cl2↑+2O2↑+4H2O,NA代表阿伏加德罗常数,下列说法正确的是
N2↑+Cl2↑+2O2↑+4H2O,NA代表阿伏加德罗常数,下列说法正确的是
A. 1mol NH4ClO4溶于水含NH4+和ClO4-离子数均为NA
B. 反应中还原产物分子数与氧化产物分子总数之比为1:3
C. 产生6.4g O2反应转移的电子总数为0.8NA
D. 0.5mol NH4ClO4分解产生的气体体积为44.8L
查看答案和解析>>
科目:高中化学 来源: 题型:
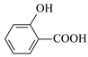
【题目】下列物质的性质比较,结论错误的是
A.硬度:金刚石>碳化硅>晶体硅
B.离子半径:S2->Cl->Na+>O2-
C.熔点:NaF>NaCl>NaBr>NaI
D.沸点:![]() >
>
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国化学侯德榜改革国外的纯碱生产工艺,生产流程可简要表示如下:
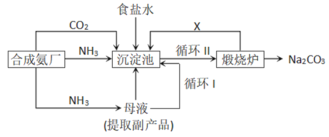
(1)实验室制取氨气的反应方程式为______
(2)上述生产纯碱过程副产品是______。
(3)沉淀池中发生的化学反应方程式是______。
(4)写出上述流程中X物质的电子式______。
(5)使原料氯化钠的利用率从70%提高到90%以上,主要是设计了______(选填循环Ⅰ或循环Ⅱ)的循环。从沉淀池中取出沉淀的操作是_________。
(6)为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后,再滴加________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锰锌铁氧体是应用广泛的高性能磁性材料。现以akg废旧碱性锌锰电池为原料(含锰元素的物质:MnO2占b%,MnOOH占c%)制备锰锌铁氧体,主要流程如下:
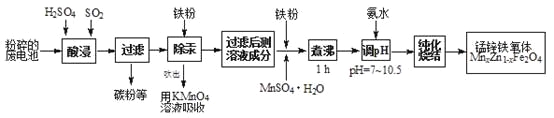
(1)酸浸废电池时,被溶解生成Zn2+的物质有______,SO2的作用是_____(填字母编号)。
A.漂白剂 | B.沉淀剂 | C.氧化剂 | D.还原剂 |
(2)除汞是以氮气为载体吹入滤液带出汞蒸汽,经KMnO4溶液吸收而实现的。如图是KMnO4溶液处于不同pH时对应的单位时间Hg去除率变化图,图中物质为Hg与MnO4-在该pH范围反应的主要产物。
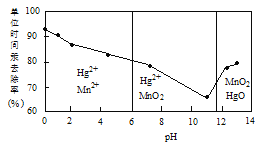
①pH<6时反应的离子方程式为___________。
②汞的去除速率随pH变化的规律是_________。
(3)锌锰干电池中MnO2可以用碳酸锰在空气中煅烧制得。
已知25℃,101 kPa时:2MnO(s)+O2(g)=2MnO2(s) H=-272.0 kJ/mol
MnCO3(s)=MnO(s)+CO2(g) H=+116.6 kJ/mol
碳酸锰在空气中煅烧反应生成MnO2的热化学方程式是_______________。
(4)x=0.2的锰锌铁氧体具有较高的饱和磁场强度,该锰锌铁氧体的组成用氧化物形式(最简整数比)表示为____________。若制得这种锰锌铁氧体的质量为100 kg,在制取过程中不考虑损耗,需补充硫酸锰晶体(MnSO4·H2O)_________kg。(只列出计算式)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com