
【题目】我国城市为了减少燃煤造成的大气污染,对于作民用燃料的煤进行了多方面的改进。
(1)为了除去煤中的含硫化合物,采用FeCl3脱硫,即用FeCl3溶液浸洗煤粉,发生如下反应:FeS2+14FeCl3+8H2O=2FeSO4+13FeCl2+16HCl。
①该反应中的氧化剂是________,若有1 mol FeS2被除去,则发生转移的电子的物质的量是________。
②为了充分利用Fe2+并减少酸(HCl)污染,本方法中可利用工业废铁屑和氯气让废液重新利用生成FeCl3。请写出这一过程中有关的离子方程式:_____________。
(2)另一种方法是采用“固硫法”,即在燃料中加入生石灰,使含硫煤在燃烧时生成的SO2不能逸出而进入炉渣中,试用化学方程式表示这一“固硫”过程:_______、________。
(3)某城市采用了以油制气代替煤作民用燃料的做法。油制气的主要成分是丙烷,请写出其燃烧的化学方程式:_____________。
(4)绿色能源是人类的理想能源,不会造成环境污染,下列能源属于绿色能源的是________。
A 氢能源 B 太阳能 C 风能 D 石油
【答案】FeCl3 14 mol Fe+2H+=Fe2++H2↑,2Fe2++Cl2=2Fe3++2Cl- SO2+CaO![]() CaSO3 2CaSO3+O2
CaSO3 2CaSO3+O2![]() 2CaSO4 C3H8+5O2
2CaSO4 C3H8+5O2![]() 3CO2+4H2O ABC
3CO2+4H2O ABC
【解析】
(1)①结合氧化还原反应理论和S元素的化合价变化解题;
②Fe和盐酸反应生成Fe2+,Fe2+能被Cl2氧化;
(2)生石灰能吸收含硫煤在燃烧时生成的SO2生成CaSO3,后氧化生成CaSO4;
(3)丙烷完全燃烧生成二氧化碳和水;
(4)能源使用后不会造成污染,则主要通过产物进行判断解决。
(1)①反应中FeS2中S由-1价升高至+6价,每1 mol FeS2被氧化,转移14 mol电子,FeCl3中Fe由+3价降至+2价,FeCl3作氧化剂;
②加入废铁屑是消耗H+,减少污染,而通入Cl2是氧化Fe2+,发生反应的离子方程式有Fe+2H+=Fe2++H2↑、2Fe2++Cl2=2Fe3++2Cl-;
(2)生石灰能吸收含硫煤在燃烧时生成的SO2,发生反应的化学方程式为SO2+CaO![]() CaSO3、2CaSO3+O2
CaSO3、2CaSO3+O2![]() 2CaSO4;
2CaSO4;
(3)丙烷完全燃烧生成二氧化碳和水,发生反应的化学方程式为C3H8+5O2![]() 3CO2+4H2O;
3CO2+4H2O;
(4)风能、太阳能、氢能等使用后不会对环境造成污染,故它们都属于绿色能源,而石油属于化石燃料,使用会生成二氧化碳及其它污染环境的气体,不属于绿色能源,故答案为D。


科目:高中化学 来源: 题型:
【题目】可逆反应:2A(气) + 3B(气) ![]() 3C(气),一定条件下,在一密闭、恒容的容器中,使一定量A和B气体反应,下列叙述能用来判断达到平衡状态的是:
3C(气),一定条件下,在一密闭、恒容的容器中,使一定量A和B气体反应,下列叙述能用来判断达到平衡状态的是:
A.各物质的浓度之比为c(A):c(B):c(C) = 2:3:3
B.气体的总体积是反应开始时的 3/5
C.混合气体的密度不变
D.单位时间内, 若消耗了 a mol A 物质, 同时也消耗了 1.5 a mol 的C物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物(![]() )的说法错误的是
)的说法错误的是
A. 该分子中的5个碳原子可能共面
B. 与该有机物含相同官能团的同分异构体只有3种
C. 通过加成反应可分别制得烷烃、醇、卤代烃
D. 鉴别该有机物与戊烷可用酸性高锰酸钾溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图甲是一种在微生物作用下将废水中的尿素CO(NH2)2转化为环境友好物质,实现化学能转化为电能的装置,并利用甲、乙两装置实现在铁上镀铜。下列说法中不正确的是

A. 乙装置中溶液颜色不变
B. 铜电极应与Y相连接
C. M电极反应式:CO(NH2)2+H2O-6e-=CO2↑+N2↑+6H+
D. 当N电极消耗0.25 mol气体时,铜电极质量减少16g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成气(CO和H2)是目前化工常用的原料,下面是用甲烷制备合成气的两种方法:
① CH4(g)+H2O(g)![]() CO(g)+3H2(g) ΔH1=+216 kJ·mol-1;
CO(g)+3H2(g) ΔH1=+216 kJ·mol-1;
② 2CH4(g)+O2(g) ![]() 2CO(g)+4H2(g) ΔH2=-72 kJ·mol-1。
2CO(g)+4H2(g) ΔH2=-72 kJ·mol-1。
其中一个反应的反应过程与能量变化关系如图所示。则下列说法正确的是( )

A. E1表示2CH4(g)+O2(g) ![]() 2CO(g)+4H2(g)的活化能
2CO(g)+4H2(g)的活化能
B. E2表示CH4(g)+H2O(g)![]() CO(g)+3H2(g)的活化能
CO(g)+3H2(g)的活化能
C. 该图示为反应②的反应过程与能量变化示意图
D. 一般情况下,加入催化剂,既能降低E1,也能降低E2,但不能改变E1与E2的差值
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于4NH3(g) + 3O2(g) = 2N2(g) + 6 H2O(g) 的反应来说,以下化学反应速率的表示中反应速率最快的是
A. v(NH3)=0.6 mol L-1min-1B. v(O2) =0.4 mol L-1min-1
C. v(N2)=0.2 mol L-1min-1D. v(H2O) =0.3 mol L-1min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L的密闭容器中发生反应xA(g)+yB(g)![]() zC(g)。图甲表示200 ℃时容器中A、B、C物质的量随时间的变化,图乙表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是( )。
zC(g)。图甲表示200 ℃时容器中A、B、C物质的量随时间的变化,图乙表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是( )。

A. 200 ℃时,反应从开始到平衡的平均速率v(B)=0.04 mol·L-1·min-1
B. 200℃时,该反应的平衡常数为25 L2/mol2
C. 当外界条件由200℃降温到100℃,原平衡一定被破坏,且正逆反应速率均增大
D. 由图乙可知,反应xA(g)+yB(g)![]() zC(g)的ΔH<0,且a=2
zC(g)的ΔH<0,且a=2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁是一种重要的化工原料,可以制备一系列物质(如图所示)。下列说法错误的是
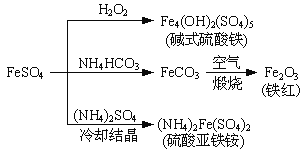
A. 碱式硫酸铁水解能产生Fe(OH)3胶体,可用作净水剂
B. 为防止NH4HCO3分解,生产FeCO3需在较低温度下进行
C. 可用KSCN溶液检验(NH4)2Fe(SO4)2是否被氧化
D. 常温下,(NH4)2Fe(SO4)2在水中的溶解度比FeSO4的大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用废蚀刻液(含![]() 及
及![]() )制备碱性蚀刻液[
)制备碱性蚀刻液[![]() 溶液]和
溶液]和![]() 的主要步骤:用
的主要步骤:用![]() 氧化废蚀刻刻液,制备氨气,制备碱性蚀刻液[
氧化废蚀刻刻液,制备氨气,制备碱性蚀刻液[![]() ],固液分离,用盐酸溶解沉淀并制备
],固液分离,用盐酸溶解沉淀并制备![]() ,下列实验装置和操作不能达到实验目的的是
,下列实验装置和操作不能达到实验目的的是
A.  制备
制备![]()
B.  制备
制备![]() 并得到
并得到![]()
C.  分离
分离![]() 溶液和
溶液和![]()
D.  将
将![]() 溶液蒸干制备
溶液蒸干制备![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com